一名肺癌患者竟然出现四种耐药机制,KRAS真是难对付
这个研究初步探索了KRAS G12C抑制剂获得性耐药的分子特征及潜在机制,发现耐药肿瘤中KRAS G12C突变等位基因频率降低以及MAPK通路重新激活。
KRAS有“最强癌基因”之称。
KRAS G12C是驱动肿瘤发生发展的重要机制之一,这个突变会导致KRAS GTP酶活性缺陷,从而提高细胞内活性GTP结合态的丰度,通过RAF/MEK/ERK/MAPK等下游效应通路促进肿瘤细胞的增殖和生长[1]。
在很长的一段时间里,KRAS都被认为是“不可成药靶点”,直到Sotorasib(AMG510)的出现。2021年5月,全球第一个KRAS突变靶向药Sotorasib被美国FDA批准上市,它对晚期非小细胞肺癌(NSCLC)患者的有效率约为32.2%,中位无进展生存期为为6.3月[2]。
虽然Sotorasib临床试验的结果令人鼓舞,但是获得性耐药限制了其长期的治疗效果,影响患者长期生存率[3]。在过去的半年之内,Dana-Farber癌症研究所的团队[3]和纪念斯隆-凯特琳癌症中心(MSKCC)的团队[4]分别报道了KRAS靶向治疗耐药的机制。
但这似乎不是KRAS的全部手段。
近日,由北卡大学教堂山分校Chad V. Pecot教授领导的研究团队,在著名期刊《临床研究杂志》(JCI)上发表了一项重要研究成果[5]。
他们深入分析了一例对Sotorasib获得性耐药的KRAS G12C突变非小细胞肺癌(NSCLC)患者的肿瘤样本,发现获得性耐药的产生涉及多重机制,包括KRAS介导的信号转导重激活、代谢重编程、上皮-间充质转化(EMT)以及肿瘤微环境的变化等。
总的来说,这个研究为深入理解KRAS G12C抑制剂耐药机制,及寻找克服肿瘤耐药潜在途径提供了重要参考依据。

接下来,我们就一起来看看Pecot团队这个研究有怎样的玄机。
这是一名77岁的男性KRAS G12C突变NSCLC患者,癌症已经全身多处转移。他接受了PD-1治疗后,开始使用Sotorasib(960毫克,每天两次)进行治疗。一开始治疗效果很好,服药7周后的全身各处的肿瘤尺寸缩小了约35%,然而到了第13周一些部位的病变出现进展,直至第17周因疾病快速进展而停药,最终这名患者很快就因肿瘤进展去世。
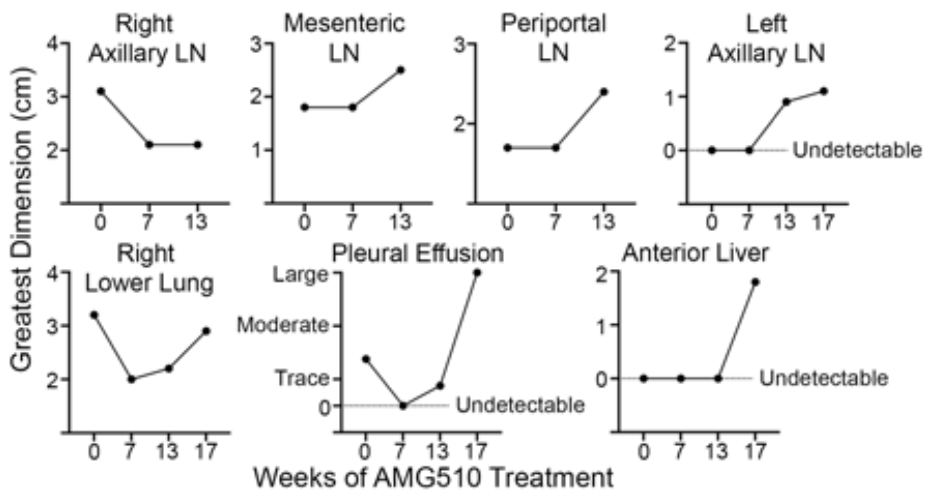
患者服用Sotorasib后随着时间推移全身各处肿瘤大小变化
为了对肿瘤获得性耐药的机制进行深入分析,研究人员对患者服药前后全身16处肿瘤样本及8处匹配的正常样本(距肿瘤>1 cm)进行RNA测序和全外显子测序。
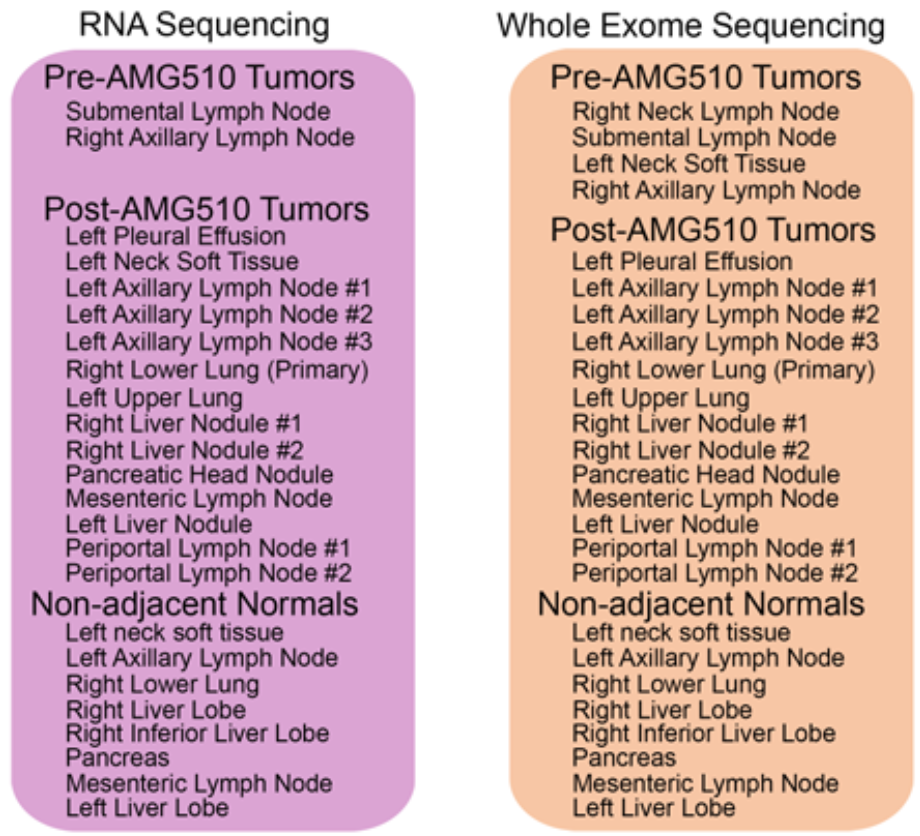
对患者服药前后肿瘤组织及匹配的正常组织进行RNA测序和全外显子测序
通过对治疗前后肿瘤样本的转录本进行分析发现,与服药前相比,服药后肿瘤样本中有950个基因表达差异明显(倍数变化>1.5,Padj<0.05),其中709个基因表达上调,241个基因表达下调。
在使用基因集变异分析(GSVA)对MSigDB致癌基因和Hallmark癌基因集进行评分后,分别发现服药后肿瘤样本具有表达显著不同的38个致癌基因集和9个Hallmark癌基因集。
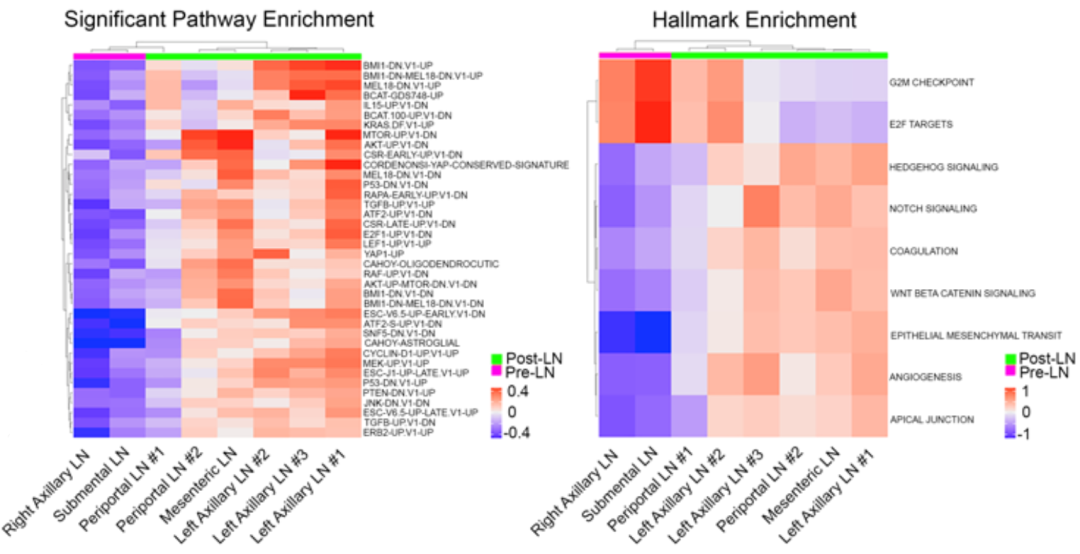
服药后肿瘤样本具有表达显著不同的38个致癌基因集和9个Hallmark癌基因集
致癌基因集显示几乎所有Sotorasib治疗后的样本都显示出MAPK信号通路、AKT/mTOR信号通路的显著激活,以及涉及转录辅助激活因子YAP1通路的显著上调。
9个Hallmark癌基因集中有2个下调的细胞周期基因集(G2/M检查点和E2F靶点,与肿瘤细胞增殖失调相一致),其他7组为上调的基因集,包括Hedgehog、Notch和Wnt/β-catenin信号通路的激活,以及EMT和肿瘤血管生成相关信号的激活。此外,研究人员还发现,服药后肿瘤代谢途径也发生改变,如脂肪酸代谢显著增强。
接着Pecot团队对样本的全外显子测序数据进行了分析,发现治疗后的肿瘤样本,相较于治疗前的肿瘤样本有更少肿瘤单核苷酸变异(SNV),且KRAS G12C突变在大多数治疗后样本中的等位基因频率降低,提示存在获得性Sotorasib耐药。不过,他们未发现可导致MAPK信号重新激活的新突变,也没有在治疗后的样本中发现新的KRAS突变。
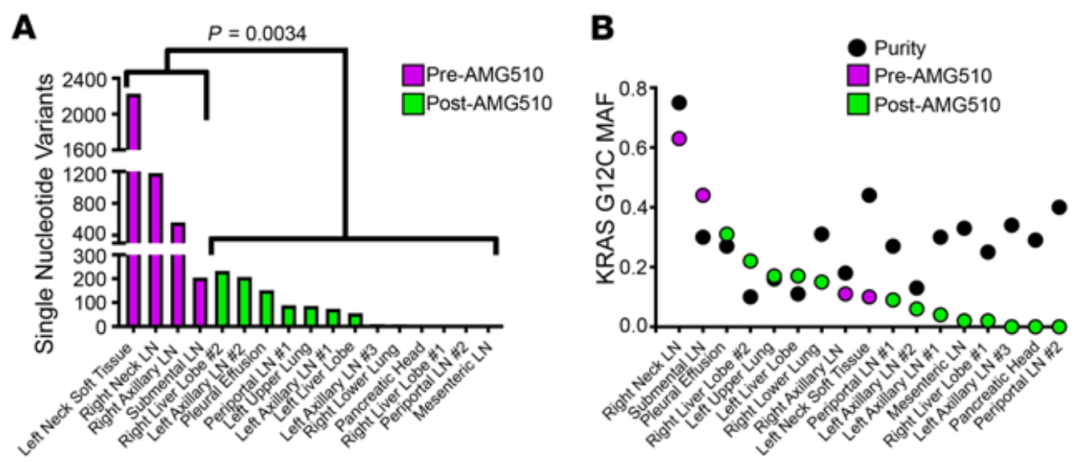
A.治疗后的肿瘤样本相较于治疗前的肿瘤样本有更少肿瘤SNV;
B.KRAS G12C突变在大多数治疗后样本中的等位基因突变频率降低
与SNV分析结果一样,Pecot团队发现服药后的样本具有较少的拷贝数变异(CNV),有15个癌症相关基因在至少3个肿瘤样本显示出拷贝数增加,然而均出现在服药前的样本中,这表明这些癌症相关基因与KRAS G12C拷贝数丢失无关,不太可能是导致发生获得性耐药的原因。
最后,Pecot团队评估了肿瘤样本中的免疫基因组学特征,以了解Sotorasib治疗前后肿瘤微环境的差异。他们发现,在治疗后的样本中,与T细胞和B细胞功能激活相关的多种免疫基因信号显著下调。
从肿瘤全外显子测序数据预测的新抗原显示,与治疗后的样本相比,治疗前的新抗原负荷更高,这与SNV数据结果相一致。这些结果都显示免疫逃逸可能是Sotorasib获得性耐药的一个关键特征。

预测的新抗原计数在样本之间分布
总的来说,这个研究初步探索了KRAS G12C抑制剂获得性耐药的分子特征及潜在机制,发现耐药肿瘤中KRAS G12C突变等位基因频率降低以及MAPK通路重新激活,然而KRAS或其下游并未有新的突变产生,这需要近一步的研究其内在原因。
此外,EMT和血管生成相关信号的激活、代谢重编程以及肿瘤微环境的变化均不同程度参与获得性耐药的产生,其中机制可能非常复杂,这也是研究人员需要去攻克的难题。






