Alzheimer&Dementia:针对Aβ治疗老年痴呆?可能效果并不大!
对于AD治疗试验的失败,有很多解释,特别是在疾病过程中治疗太晚,针对错误的目标,或者治疗未能正确地与目标接触。也有可能不是所有的认知能力下降,即使被诊断为AD也不是因为Aβ和tau导致的神经变性。
尽管淀粉样纤维蛋白β(Aβ)在大脑中的沉积被确定为最早的病理变化之一,至少在阿尔茨海默病(AD)的临床诊断前十年就已发生,但迄今为止,针对Aβ的治疗在减缓认知能力下降方面基本上是无效的,最近有报道称其临床效果不大。
对于AD治疗试验的失败,有很多解释,特别是在疾病过程中治疗太晚,针对错误的目标,或者治疗未能正确地与目标接触。也有可能不是所有的认知能力下降,即使被诊断为AD也不是因为Aβ和tau导致的神经变性。
既然如此,AD病理学在多大程度上解释了AD患者的临床症状和疾病进展,这对于有效疗法的开发和定位确实有很大的意义。为了回答上述问题,来自美国加州旧金山退伍军人事务医疗中心的专家开展了相关研究,结果发表在Alzheimer&Dementia杂志上。

该研究在248名Aβ阳性的认知障碍和痴呆老人中,采用偏最小二乘法结构方程路径模型评估成像生物标志物(全局Aβ-PET摄取、区域tau-PET摄取和基于MRI的区域萎缩)和风险因素(年龄、性别、教育、脂蛋白E[APOE]和白质损伤)对横断面认知障碍和纵向认知下降的直接和间接影响。
结果显示,Aβ占横断面认知损害变异的16%,tau占46%-47%,脑萎缩占25%-29%,但认知损害总变异的53%-58%是由AD危险因素的中介和直接效应解释的。Aβ-tau-萎缩途径占纵向认知衰退变异的50%-56%,而Aβ、tau和萎缩分别独立解释了16%、46%-47%和25%-29%的变异。
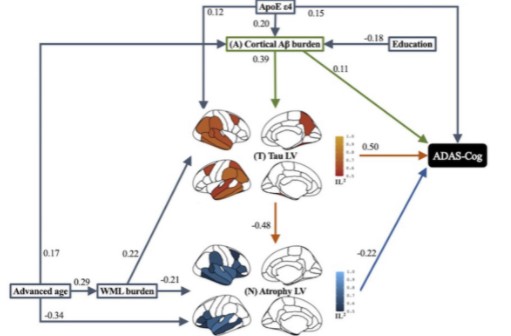
介导AD风险因素对基线认知结果测量的mPACC和ADAS-Cog在整个AD连续性的影响。
在很大程度上,认知衰退模型中确定的重要途径与基线认知障碍模型中的途径相似,但男性对tau潜伏变量(LV)有显著的直接影响,但对任何一个认知衰退指标都没有影响;更大的WML对ΔADAS-Cog有显著的直接影响,但对ΔmPACC没有影响。
综上,该研究提示,去除Aβ和tau对神经变性及下游影响的治疗方法在减缓老年痴呆认知衰退或逆转认知损害方面效果可能不会很大。
参考文献:
Contribution of Alzheimer's biomarkers and risk factors to cognitive impairment and decline across the Alzheimer's disease continuum. https://doi.org/10.1002/alz.12480






