Nature Communications:包小平团队开发CAR-中性粒细胞递药系统,用于治疗致命脑肿瘤
胶质母细胞瘤(GBM)是最具侵袭性原发性脑肿瘤(之一),具有死亡率高、生存期短、预后差、复发率高的特点。在过去的几十年里,针对胶质母细胞瘤(GBM)的治疗效果几乎没有取得什么突破性进展,患者5年生存率仅为5%左右。 在胶质母细胞瘤的治疗中,手术和化疗药物的治疗效果主要受到精细脑结构、血脑屏障(BBB)或血脑肿瘤屏障(BBTB)的阻碍。特别是,将治疗脑肿瘤的药物给药到中枢神经系统(CNS)非常具有
胶质母细胞瘤(GBM)是最具侵袭性原发性脑肿瘤(之一),具有死亡率高、生存期短、预后差、复发率高的特点。在过去的几十年里,针对胶质母细胞瘤(GBM)的治疗效果几乎没有取得什么突破性进展,患者5年生存率仅为5%左右。
在胶质母细胞瘤的治疗中,手术和化疗药物的治疗效果主要受到精细脑结构、血脑屏障(BBB)或血脑肿瘤屏障(BBTB)的阻碍。特别是,将治疗脑肿瘤的药物给药到中枢神经系统(CNS)非常具有挑战性。已发表的数百项研究显示,给药的纳米颗粒剂量被递送到实体瘤的比例不足1%,而被递送到脑肿瘤中的不足0.8%。
中性粒细胞(Neutrophils)具有向炎症部位迁移、穿越血脑屏障/血脑肿瘤屏障和浸润实体瘤的天然能力,因此可用于增强对脑肿瘤的靶向药物递送,以提高治疗效果。然而,在中性粒细胞/化疗给药之前,需要侵入性手术切除肿瘤或肿瘤微环境启动来诱导中性粒细胞募集的额外炎症,这导致炎性手术边缘以外肿瘤部位的中性粒细胞募集有限。此外,中性粒细胞递送的化疗药物主要富集于脾脏,而不富集于脑肿瘤部位。中性粒细胞寿命短且易在体外凋亡,在患者术前大量提取中性粒细胞用于药物递送可能导致其中性粒细胞减少,这些障碍是的使用人类中性粒细胞进行药物递送的可行性及安全性难以捉摸。因此,迫切需要一种安全有效的人中性粒细胞介导的仿生给药系统。
2023年4月20日,普渡大学包小平团队等在 Nature 子刊 Nature Communications 上发表了题为:CAR-neutrophil mediated delivery of tumor-microenvironment responsive nanodrugs for glioblastoma chemo-immunotherapy 的研究论文。
研究团队使用CRISPR-Cas9介导的基因敲入对人类多能干细胞(hPSC)进行基因工程改造,以表达具有T细胞特异性CD3ζ或中性粒细胞特异性γ信号域的各种抗胶质母细胞瘤CAR结构,从而构建出具有最佳抗肿瘤活性的CAR-中性粒细胞(CAR-NE),其能够特异性且无创地递送和释放肿瘤微环境响应的纳米药物,以靶向胶质母细胞瘤,而无需在肿瘤部位诱导额外的炎症。
这种化学免疫联合疗法在肿瘤小鼠模型中表现出优越的特异性抗胶质母细胞瘤活性,减少药物脱靶递送并延长了肿瘤小鼠寿命。
总的来说,该研究开发的仿生CAR-中性粒细胞给药系统是一种安全、有效和通用的药物递送平台,为胶质母细胞瘤等毁灭性疾病带来了新的潜在治疗手段。

嵌合抗原受体(CAR)修饰的T细胞(CAR-T)或自然杀伤细胞(CAR-NK)具有显着的抗肿瘤活性,但它们在实体瘤中的疗效仍然有限,部分原因是它们相对较低的递送和肿瘤穿透能力。生理性血脑屏障(BBB)和血脑肿瘤屏障(BBTB)的存在进一步阻碍了这些新兴细胞疗法对胶质母细胞瘤(GBM)的疗效。
中性粒细胞对各种癌症具有先天免疫和可塑性,但其作为药物递送细胞载体的应用研究较少。在这项研究中,包小平团队等认为CAR-中性粒细胞(CAR-NE)可能在胶质母细胞瘤的治疗中产生良好的效果。
原代中性粒细胞寿命较短,对基因组编辑具有抗性,这限制了它们在CAR修饰的免疫治疗中的应用。人类多能干细胞(hPSC)更容易进行基因组编辑,然后再大量分化为中性粒细胞,从而为免疫治疗提供大量的高质量CAR-中性粒细胞来源。
在这项工作中,研究团队设计和筛选了四种具有T细胞或中性粒细胞特异性信号域的抗胶质母细胞瘤的氯离子通道毒素(CLTX)-CAR结构,通过CRISPR-Cas9介导的同源重组将它们敲入hPSC的AAVS1安全港位点,并鉴定了一种优化的CAR,其由36个氨基酸的胶质母细胞瘤靶向CLTX肽,CD4跨膜结构域和CD3ζ胞内结构域组成,用于中性粒细胞介导的肿瘤杀伤。
由此产生的稳定表达CAR的hPSC分化为CAR-中性粒细胞,其维持了抗肿瘤N1表型,并在缺氧肿瘤微环境下表现出增强的抗胶质母细胞瘤活性。
接下来,研究团队合成了一种具有粗糙表面的可生物降解介孔有机二氧化硅纳米颗粒(R-SiO2),并用于将化疗药物替拉扎明(TPZ)或替莫唑胺(TMZ)和JNJ-64619187装载到hPSC分化而来的CAR-中性粒细胞中,这些中性粒细胞不受纳米负载的伤害,并保留幼稚中性粒细胞固有的生物生理特性。
CAR-中性粒细胞装载含有化疗药物的SiO2纳米颗粒,显示出优越的抗胶质母细胞瘤活性,这可能是由于CAR增强的直接细胞溶解和化疗介导的肿瘤杀伤的结合。

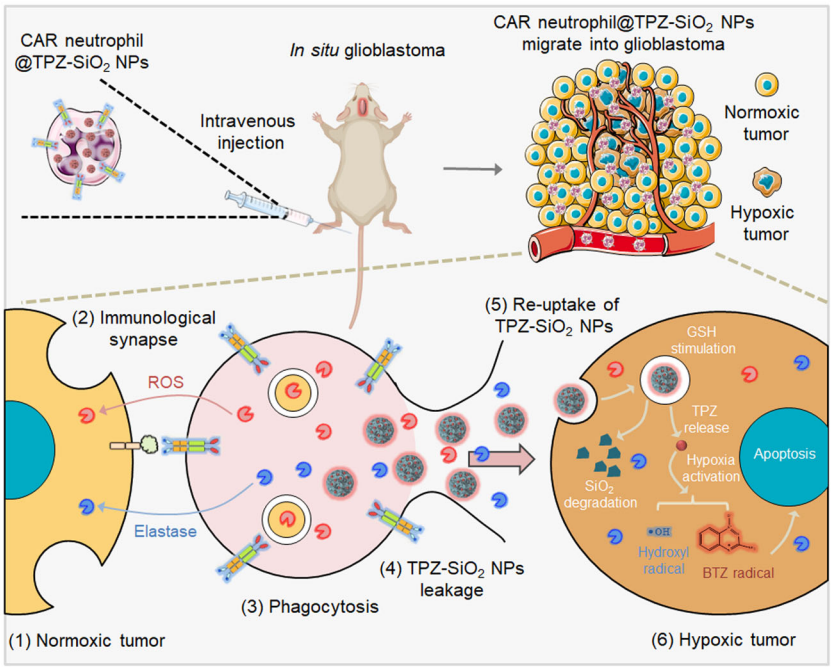
在原位胶质母细胞瘤异种移植模型中,hPSC分化而来的CAR-中性粒细胞精确有效地将负载替拉扎明(TPZ)的SiO2纳米颗粒递送到脑肿瘤中,而无需侵入性手术切除以扩大炎症,并显着抑制了脑肿瘤生长,延长动物存活时间,这代表了一种靶向和有效的化学-免疫联合治疗。
值得注意的是,通过对硅含量的检测表明,20%的纳米药物通过CAR-中性粒细胞递送到了脑肿瘤中,这远超常规纳米药物通过循环系统的不足1%的脑肿瘤递送效率。
总的来说,这项研究开发了一种仿生CAR-中性粒细胞递药系统,并证明了其可作为一种安全、有效和通用的药物递送平台,可用于治疗胶质母细胞瘤和其他毁灭性疾病。
原始出处:
Chang, Y., Cai, X., Syahirah, R. et al.CAR-neutrophil mediated delivery of tumor-microenvironment responsive nanodrugs for glioblastoma chemo-immunotherapy. Nat Commun 14, 2266 (2023). https://doi.org/10.1038/s41467-023-37872-4.






