贫血新药!BMS首创红细胞成熟剂Reblozyl获美国FDA授予第三个孤儿药资格,治疗骨髓纤维化!
百时美施贵宝(BMS)与Acceleron制药公司合作开发的红细胞成熟剂Reblozyl(luspatercept)近日获美国食品和药物管理局(FDA)授予治疗骨髓纤维化(myelofibrosis)的孤儿药资格(ODD)。值得一提的是,这也是该药在FDA方面获得的第三个ODD。此前,FDA已授予luspatercept治疗β地中海贫血和骨髓增生异常综合症(MDS)的ODD。
百时美施贵宝(BMS)与Acceleron制药公司合作开发的红细胞成熟剂Reblozyl(luspatercept)近日获美国食品和药物管理局(FDA)授予治疗骨髓纤维化(myelofibrosis)的孤儿药资格(ODD)。值得一提的是,这也是该药在FDA方面获得的第三个ODD。此前,FDA已授予luspatercept治疗β地中海贫血和骨髓增生异常综合症(MDS)的ODD。
孤儿药(Orphan Drug)是指用于预防、治疗、诊断罕见病的药品,而罕见病是一类发病率极低的疾病的总称,又称“孤儿病”。在美国,罕见病是指患病人群少于20万的疾病类型,罕见病药物研发方面的激励措施包括各种临床开发激励措施,如临床试验费用相关的税收抵免、FDA用户费减免、临床试验设计中FDA的协助,以及药物上市后针对所批准适应症为期7年的市场独占期。
Reblozyl是一种红细胞成熟剂,已于2019年11月获得美国FDA批准,用于需要定期输注红细胞的β地中海贫血成人患者,治疗贫血。
值得一提的是,Reblozyl是首个获FDA批准治疗β地中海贫血相关贫血的药物,同时是首个获得DA批准的红细胞成熟剂,代表了新一类的疗法,通过调节红细胞成熟后期阶段来帮助患者减少红细胞输注负担。需要指出的是,Reblozyl在需要立即纠正贫血的患者中不适用于作为红细胞输注的替代品。
目前,Reblozyl治疗MDS贫血的生物制品许可申请(BLA)正在接受FDA的审查,该BLA申请批准Reblozyl用于骨髓涂片存在环形铁幼粒细胞(ring sideroblast,RS+)、需要常规输注红细胞(RBC)、极低危至中危MDS成人患者治疗贫血,处方药用户收费法(PDUFA)目标日期为2020年4月4日。在欧洲,Reblozyl治疗成人β地中海贫血和MDS贫血的营销授权申请(MAA)正在接受欧洲药品管理局(EMA)的审查。
Reblozyl的活性药物成分为luspatercept,这是一种首创的(first-in-class)红细胞成熟剂(EMA),可调节晚期红细胞的成熟。
该药是一种可溶性融合蛋白,由人IgG1的Fc结构域与激活素IIB型受体(ActRIIB)胞外结构域融合而成,作为一种配体陷阱,通过靶向结合可调节晚期RBC成熟的转化生长因子(TGF)-β超家族的特定配体,减少Smad2/3信号通路的激活,改善无效红细胞的生成,促进晚期红细胞的成熟,提高血红蛋白水平。
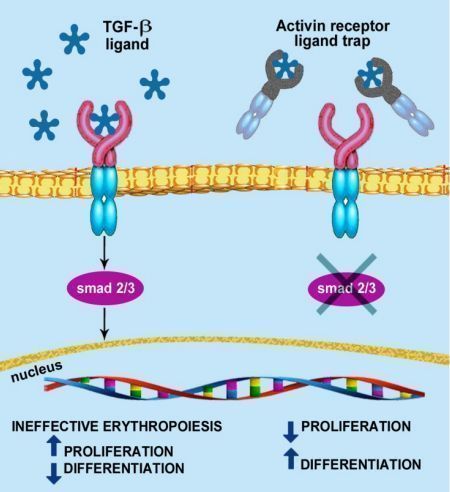
luspatercept的作用机制
luspatercept由新基(已被BMS收购)与Acceleron制药公司合作进行全球开发。目前,双方也正在评估luspatercept治疗促红细胞生成刺激剂(ESA)初治、低危MDS患者(III期COMMANDS研究)和非输血性β地中海贫血(II期BEYOND研究)以及骨髓纤维化的潜力。业界对luspatercept的商业前景也十分看好。去年底,EvaluatePharma发布报告《Vantage 2019 Preview》,盘点了全球20个最有价值的研发项目,luspatercept以31亿美元的净现值(NPV)位列第18位。
此前,华尔街著名投资银行Jefferies分析师指出,如果骨髓增生异常综合症(MDS)贫血也获得FDA批准,Reblozyl的年销售峰值将达到20亿美元。






