Sci Adv:饥饿状态下激活杏仁核-臂旁核神经环路促进摄食
经典观点认为调控稳态进食的大脑主要位于下丘脑,而享乐进食由边缘和奖赏系统控制,包括海马体、杏仁核、前额叶皮层、伏核和腹侧被盖区。最新观点认为无论是稳态进食还是享乐进食,调控稳态进食和享乐进食的大脑环路均处于激活态。 中央杏仁核(CeA)控制情绪处理并促进防御和食欲行为,主要由-氨基丁酸释放(GABA能)神经元组成,可进一步细分为内侧中央核( CeM)、中央囊区(CeC)和外侧中央核(CeL)。C
经典观点认为调控稳态进食的大脑主要位于下丘脑,而享乐进食由边缘和奖赏系统控制,包括海马体、杏仁核、前额叶皮层、伏核和腹侧被盖区。最新观点认为无论是稳态进食还是享乐进食,调控稳态进食和享乐进食的大脑环路均处于激活态。
中央杏仁核(CeA)控制情绪处理并促进防御和食欲行为,主要由γ-氨基丁酸释放(GABA能)神经元组成,可进一步细分为内侧中央核( CeM)、中央囊区(CeC)和外侧中央核(CeL)。CeA表达蛋白激酶Cδ的神经元(CeA-PKCδ)在厌食性线索下产生抑制进食的作用,表达血清素受体2a(Htr2a)神经元(CeA-Htr2a)通过增加食物的可口性来诱导进食。
2023年5月25日德国马克斯·普朗克生物智能研究所Rüdiger Klein团队揭示了在饥饿状态下激活CeA-Htr2a活性并抑制PBN活性发挥促进摄食的作用。

1
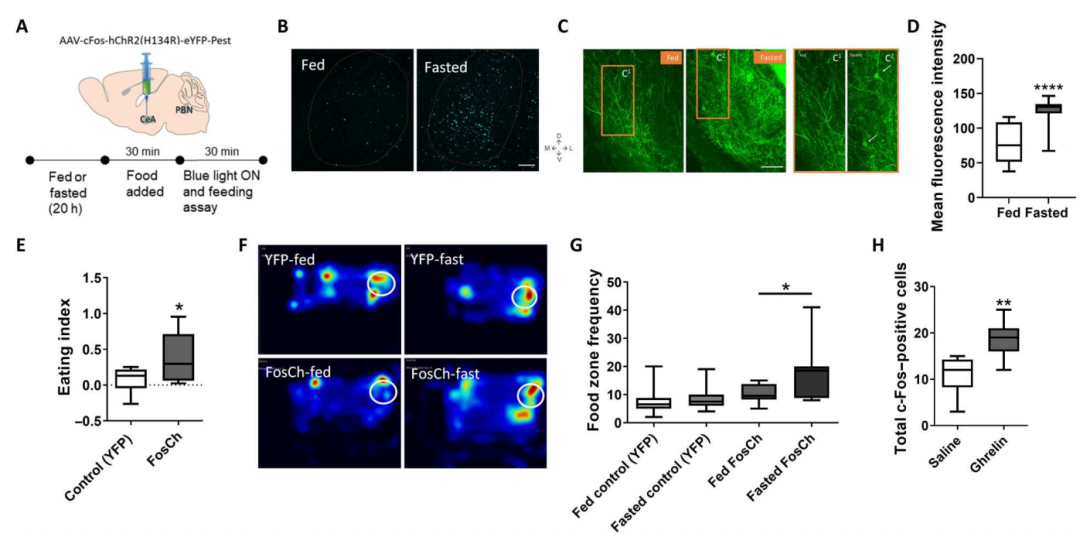
禁食或胃饥饿素激活CeA-Htr2a神经元
研究人员通过单细胞测序技术发现CeA脑区不同亚区存在9种抑制性神经元,CeC-Calcrl和CeL-PKCδ主要与厌恶行为相关,CeL-NTS、CeL-Tac2、CeL-Sst、CeM-Il1Rapl2神经元主要与食欲相关,CeA-Htr2a神经元与摄食行为相关。
免疫荧光实验发现在禁食后小鼠CeA神经元活性增强。腹腔注射胃饥饿素促进小鼠摄食,也会引起饱腹小鼠CeA神经元激活增多。更进一步实验发现胃饥饿素更多激活CeA-Htr2a神经元,几乎不激活CeA-PKCδ神经元。
光纤钙成像技术发现在进食过程中CeA-Htr2a神经元活性增强。即便在无食物供应情况下,胃饥饿素也能增加CeA-Htr2a神经元活性,在给与食物供应后,这种活性的增强更加明显。
2
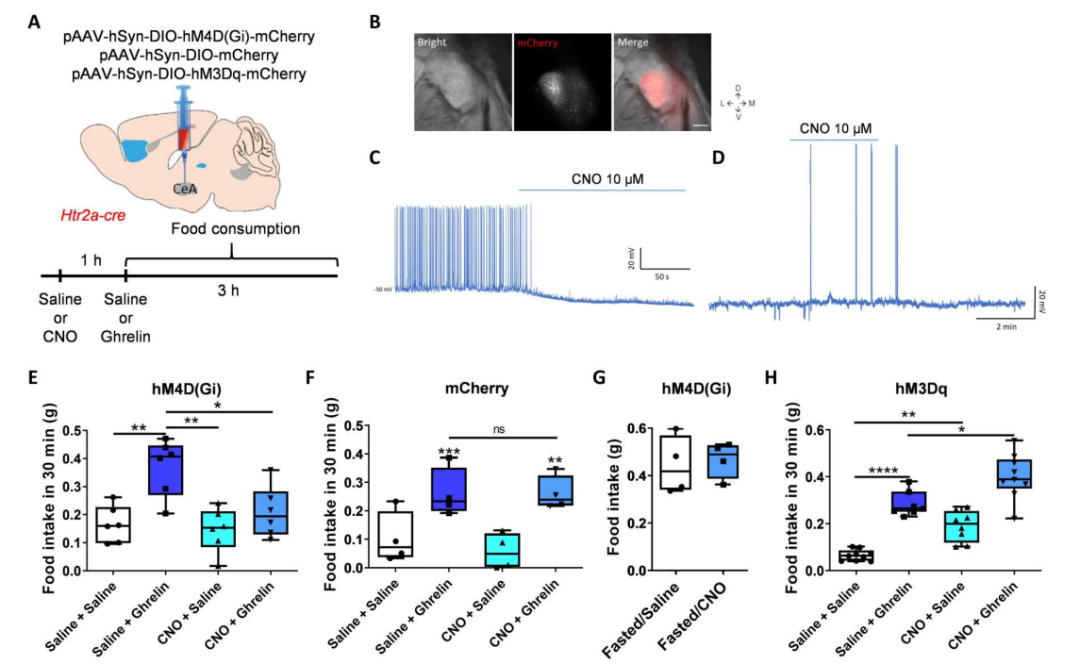
激活CeA-Htr2a神经元促进摄食
电生理实验发现(与进食小鼠相比)禁食小鼠CeA-Htr2a神经元放电活动增强,孵育胃饥饿素也能明显增加CeA-Htr2a神经元放电活动,增强自发性兴奋性突触后电流频率,但几乎不影响CeA-PKCδ神经元电活动。
化学遗传学慢性抑制CeA-Htr2a神经元活性后并不影响小鼠在饱腹状态下的摄食行为,但可完全阻断胃饥饿素引起的促摄食行为效应。在激活CeA-Htr2a神经元可进一步增强饥饿素引起的促摄食行为效应,这种增强作用可被饥饿素拮抗剂所阻断。
3
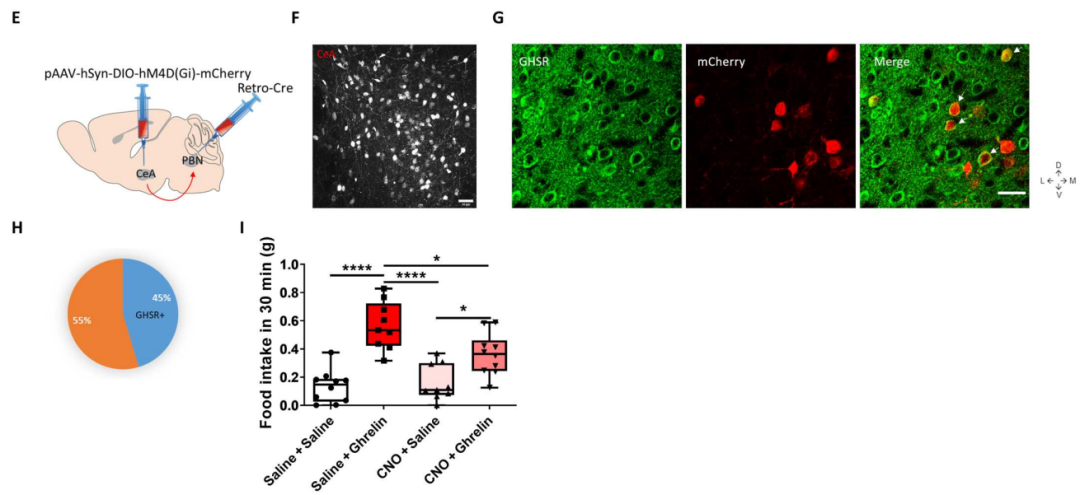
胃饥饿素通过CeA-Htr2a→PBN环路促进摄食
已有研究表明CeA-Htr2a神经元投射到臂旁核PBN。逆行示踪实验发现PBN逆行投射到CeA的神经元在孵育胃饥饿素后可增强兴奋性突触传递作用。Htr2a-cre工具小鼠中也发现胃饥饿素或禁食也能激活CeA-Htr2a→PBN环路。此外,禁食状态下或孵育胃饥饿素后PBN神经元放电活动减弱。化学遗传学慢性抑制CeA-Htr2a→PBN环路后可明显阻断胃饥饿素的促摄食作用。
总结
以往杏仁核的研究主要在调控抑郁、焦虑、恐惧记忆等领域,本文揭示了杏仁核通过胃饥饿素信号调控摄食行为。
原始出处:
Peters et al.Transcriptomics reveals amygdala neuron regulation by fasting and ghrelin thereby promoting feeding. Sci. Adv. 9, eadf6521 (2023).






