Aβ和tau病理协同作用诱发AD特定阶段的小胶质细胞新亚型分析
在与晚发性AD相关的风险等位基因中,那些汇集于小胶质细胞活性调控的等位基因已成为疾病进展的核心。然而在AD的发展进程中,典型的淀粉样蛋白- (A)和tau蛋白病理是如何调节小胶质细胞亚型的尚不清楚。近期《Molecular Neurodegeneration》发表了题为Amyloid-beta and tau pathologies act synergistically to induce n
在与晚发性AD相关的风险等位基因中,那些汇集于小胶质细胞活性调控的等位基因已成为疾病进展的核心。然而在AD的发展进程中,典型的淀粉样蛋白-β (Aβ)和tau蛋白病理是如何调节小胶质细胞亚型的尚不清楚。近期《Molecular Neurodegeneration》发表了题为“Amyloid-beta and tau pathologies act synergistically to induce novel disease stage-specific microglia subtypes”的研究文章,使用了单细胞RNA测序来分析在疾病进展过程中同时表现出Aβ和tau病变的小鼠的小胶质细胞亚型。
作者团队确定了新的小胶质细胞亚型:早期阶段的AD相关小胶质细胞(EADAM)和晚期AD相关小胶质细胞(LADAM)。这些新的小胶质细胞亚型与疾病的特定阶段相关,并且在应对Aβ和tau病变时都会被诱导。另外作者团队从不同Braak阶段的人类额上回(SFG)和内嗅皮层(ERC)生成的一个snRNA-Seq数据集的结果也显示Aβ和tau病变都是EADAM和LADAM疾病分期特异性诱导的必要条件。

背景
神经炎症越来越被认为是神经退行性疾病进展的关键调控因素。最近的研究表明,神经炎症是Aβ斑块和tau神经纤维缠结之间的一个机制联系,这些病理被认为是导致突触丧失和神经元死亡的典型AD病理。除了AD易感基因如APP、PSEN1和PSEN2(早发性家族性AD)和APOE(晚发性AD)外,在调控免疫调节的基因中还发现了几个其它的晚发性AD的危险等位基因,如TREM2、磷酸肌醇磷脂酶Cγ2 (PLCG2)和CD33等。
小胶质细胞作为大脑固有的免疫细胞,在大脑健康和神经退行性疾病如AD的进展中发挥多种功能。根据疾病的不同阶段,小胶质细胞可能保护神经退行性蛋白病和/或促进炎症损伤。小胶质细胞通过清除细胞碎片,包括Aβ斑块和tau蛋白聚集物来维持大脑健康。小胶质细胞的激活与人的认知和灰质体积呈正相关,表明小胶质细胞可以起到保护作用(至少在早期AD阶段如此)。然而,小胶质细胞也会分泌促炎因子,并可直接导致tau蛋白病理及后续的神经毒性。小胶质细胞在维持吞噬/清除和促炎介质释放之间的平衡中的这种双重作用被认为是AD进展的关键和潜在的靶向决定因素。
近年来的研究发现,小胶质细胞的不同亚型显示出具有动态的反应和功能范围,强调了小胶质细胞能够担任各种重要的生理角色。大量组织的转录组分析显示小胶质细胞的疾病变化与AD有关。因此,后续的单细胞RNA测序(scRNA-Seq)方法对于确定疾病背景相关的小胶质细胞亚型是必要的。scRNA-Seq揭示了小胶质细胞空间和发育的异质性,并提供了在疾病进展过程中小胶质细胞亚型转录景观的高分辨率视图。由于AD是一种慢性疾病,前驱期长达数十年,因此了解小胶质细胞亚型对疾病分期特异性影响是必要的,也有利于澄清小胶质细胞激活的双重性质。疾病相关小胶质细胞DAM(DAM是一种独特的TREM2依赖亚型,表达CD11c,在淀粉样变小鼠模型中定位于Aβ斑块附近)的发现支持了这一观点。尽管有这些进展,一个关键的尚未解决的问题是是否存在疾病分期特异性的小胶质细胞亚型,它们对Aβ和tau病变均有反应。这些小胶质细胞亚型将成为改变疾病进展的新的治疗靶点。
在本研究中作者使用AD小鼠模型(Tau4RΔK-AP小鼠),在该模型中,野生型tau蛋白转化为tau聚集物,以神经炎斑块依赖的方式驱动神经元丧失。该动物模型作为一个优秀的小鼠模型能够用来描述AD样疾病进展不同阶段的小胶质细胞亚型。为了评估需要Aβ和tau病变来诱发疾病分期特异性小胶质细胞亚型的需求,也对控制小鼠积累Aβ斑块(APP;PS1小鼠)或tau蛋白缠结(Tau4RΔK小鼠)的对照组进行了分析。利用scRNA-Seq方法作者发现小胶质细胞对Aβ和tau病变的发展以疾病阶段特异性的方式作出反应。在6月龄的Tau4RΔK-AP小鼠(而不是APP;PS1或Tau4RΔK小鼠)的早期疾病中,Aβ和tau病变的出现诱导了一种新的小胶质细胞亚型,作者称之为早期AD相关小胶质细胞(EADAM)。与DAM不同的是EADAM表达多种干扰素调节基因。作者发现EADAM的特征基因也与AD早期(Braak II)阶段大脑中的一个小胶质细胞亚群相关。在晚期疾病中(12月龄的Tau4RΔK-AP小鼠),作者发现另一种新的小胶质细胞亚型出现在tau蛋白病理反应中并定义为AD相关的晚期小胶质细胞(LADAM),它能表达MHC和S100家族基因。
作者团队进一步观察到一种位于白质附近的独特的LADAM亚型,它在分子上类似于先前发现的白质相关的小胶质细胞亚型(WAM),该亚型在衰老过程中增加,并在Aβ和tau病变中经历额外的分子转变。LADAM小胶质细胞(包括WAM样LADAM)出现在AD晚期(Braak VI),而未出现在AD早期(Braak II)。作者还进一步发现唾液酸结合免疫球蛋白样凝集素(Siglec)家族成员与特定的小胶质细胞亚群相关。例如,siglec-F在Aβ病理反应中上调,并在Aβ相关的DAM中选择性表达,而siglec-G在AD晚期白质相关的LADAM中上调。这些发现与Aβ或tau病理刺激小胶质细胞不同模式激活的模型一致。Aβ和tau的病理机制都是诱导EADAM和LADAM出现的必要条件,这些发现为AD的新分子靶点的确定和治疗策略提供了重要的启示。
结 果
为了确定AD样病理进展对应的小胶质细胞亚型,作者团队对具有Aβ斑块和/或tau病理的转基因小鼠的大脑皮层和海马中进行了scRNA-Seq。作者团队使用突变体APPswe;PS1ΔE9 (APP;PS1)和Tau4RΔK小鼠的杂交育种策略繁育出了之前描述的AD小鼠模型(Tau4RΔK-AP mice)。
该模型小鼠表现出AD样病理,包括Aβ斑块和tau蛋白缠结,并导致进行性神经元丧失和脑萎缩。其中6月龄的Tau4RΔK-AP小鼠模拟AD早期阶段,特征是Aβ斑块水平低,tau蛋白磷酸化少。12月龄的Tau4RΔK-AP小鼠模拟疾病晚期,特征为大量Aβ斑块、tau沉积、神经元缺失和脑萎缩。然后,作者团队对6月龄和12月龄小鼠的4种基因型的组织进行了scRNA-Seq分析。
01
鉴定Aβ斑块和tau沉积诱导的新型早期AD相关小胶质细胞(EADAM)
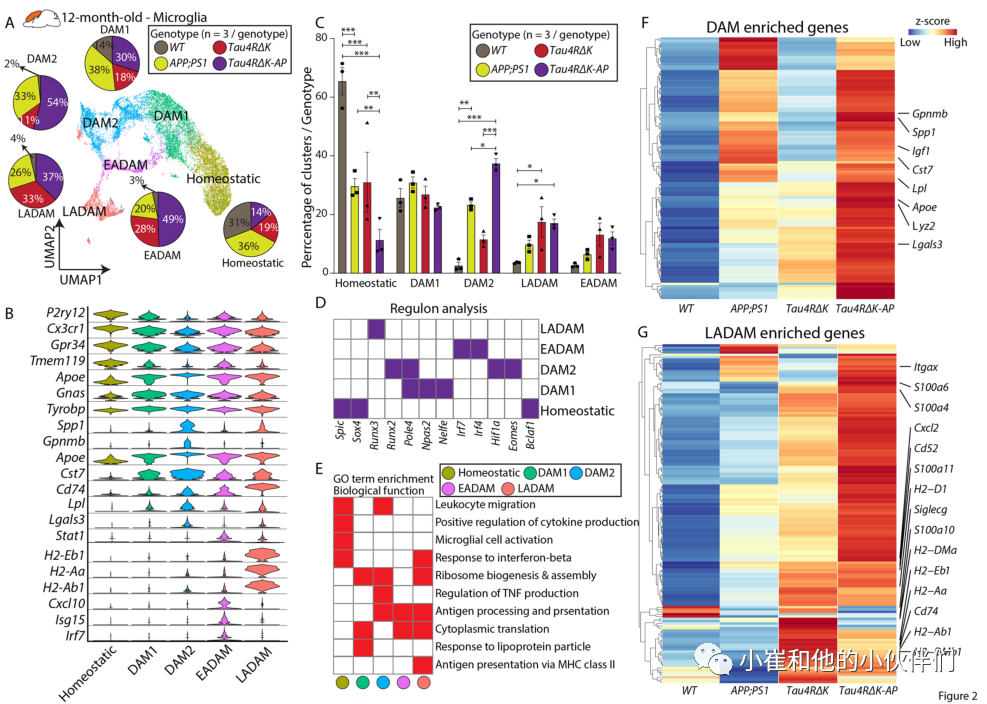
作者团队对6月龄的Tau4RΔK-AP小鼠及其它三种对照组小鼠的大脑皮层和海马体中的小胶质细胞进行了亚群和剖面分析,结果显示稳态小胶质细胞表达基因如Tmem119和P2ry12等在所有基因型小鼠中都能检测到(图1A, B),另外还观察到两个额外的小胶质细胞簇(图1A)。第一个小胶质细胞簇表达经典的DAM1样标记物,包括ApoE、Cst7和LPL(图1B)。第二个小胶质细胞簇除了表达DAM1样标记物,还显示出一个独特的由干扰素相关基因组成的基因模块,如Ifitm3、Ifit27l2a和Ifit3以及Stat1(图1B)。
由于该细胞簇主要由Tau4RΔK-AP小胶质细胞组成,并在疾病的早期和无症状阶段检测到(图1C),因此作者团队将该细胞集群定义为早期AD相关小胶质细胞(EADAM)。进一步的调控和通路分析证实了EADAM与干扰素调节转录因子Irf2/7/9有关(图1D),并与GO分析中“对干扰素- β的应答”调控相关(图1E)。APP;PS1小鼠的小胶质细胞中也发现了类似EADAM的小簇(图1A, C)。这一观察结果与之前报道的Aβ斑块积聚导致干扰素通路激活一致。在7月龄的5xFAD snRNA-Seq数据中也检测到一小簇类似EADAM样小胶质细胞的细胞簇,表达Irf7和其他EADAM 富集基因,如Ifit3, Isg15, Ifi27l2a(图1F)。
接下来,作者团队比较了四种基因型小鼠中EADAM相关基因表达差异。尽管APP;PS1小胶质细胞对EADAM簇的贡献显著,但在APP;PS1小胶质细胞中,EADAM富集基因的整体表达水平远低于Tau4RΔK-AP EADAM(图1F)。另外,在Tau4RΔK小胶质细胞中未观察到干扰素通路相关基因的表达,提示虽然Aβ斑块的积累导致了干扰素通路的激活,但在Tau4RΔK-AP小胶质细胞中充分诱导EADAM基因模块同时需要Aβ斑块和tau聚集。总之,作者团队确定了一种名为EADAM的新小胶质细胞亚型,它是由AD早期Aβ斑块和tau沉积联合诱导的。

02
晚期AD相关小胶质细胞(LADAM)的鉴定
为了进一步阐明Aβ斑块和tau蛋白在晚期小胶质细胞病理生理学中的影响,作者团队将12月龄涵盖4种基因型(WT, APP;PS1, Tau4RΔK和Tau4RΔK-AP) 小鼠的小胶质细胞亚群无偏细分为5个不同的簇。结果发现,12月龄的小鼠的DAM集群可以进一步划分为两个集群—DAM1和DAM2。DAM1集群表达Tyrobp、Ctsd、C1qa等基因(图2A、B),而DAM2则表达了富含DAM1的基因和其他与疾病相关的基因,如Gpnmb、Cst7和Spp1(图2)。
事实上,这两个簇在Aβ病理的动物模型中高度表达(APP;PS1和Tau4RΔK-AP小鼠,图2A, C),但在只有tau病理的小鼠模型(Tau4RΔK小鼠)中DAM2丰度较低(图2A, C)。这些观察结果说明这些DAM簇主要是由a β斑块引起的。与6月龄小鼠EADAM情况类似,Tau4RΔK-AP小鼠通常比APP;PS1小鼠具有更高水平的DAM富集基因(图2F)。由于Tau4RΔK-AP小鼠的Aβ斑块水平与APP;PS1小鼠相似,这一观察表明,虽然Aβ斑块可以诱导DAM2,但tau沉积和/或神经元缺失可进一步增强Tau4RΔK-AP小鼠的DAM富集。作者团队还观察到一种独特的在6月龄小鼠中未检测到的小胶质细胞簇 (图2A)。该簇中的细胞表达MHC II类基因,如Cd74、H2-A2、H2-Eb1和H2-Ab1,以及其他标记物,如Lgals3(图2B)。
作者团队将这些小胶质细胞称为晚期AD相关小胶质细胞,在Tau4RΔK-AP,以及Tau4RΔK和APP/PS1样本中均有发现(图2A, C)。进一步的调控分析确定了与所有小胶质细胞簇中的基因调控网络相关的关键转录因子。值得注意的是,Hif1a和Eomes在DAM2中选择性表达,而Runx3和Irf4/7在LADAM中表达(图2D),并且在LADAM上的GO分析也显示富集“MHC Class II”(图2E)。除了MHC II类基因外,作者团队还发现S100a家族基因的丰富表达,包括S100a4、S100a6和S100a10(图2G)。虽然在Tau4RΔKAP,Tau4RΔK和APP;PS1样本中都观察到了LADAM,但是许多LADAM特异性基因(如MHC Class II基因)在Tau4RΔK中比在APP/PS1小胶质细胞中表达更高(图2G),提示这种小胶质细胞亚型可能是由tau蛋白病的发展(如tau蛋白缠结或tau蛋白磷酸化)所诱导的。
此外,相对于Tau4RΔK小胶质细胞,作者发现LADAM基因表达在Tau4RΔK-AP小胶质细胞中更为明显(图2G)。这些数据集表明,tau病变足以诱导LADAM的出现,而其扩增则是Aβ斑块依赖的。
03
疾病特定阶段依赖性小胶质细胞亚型的出现需要Aβ斑块和tau沉积
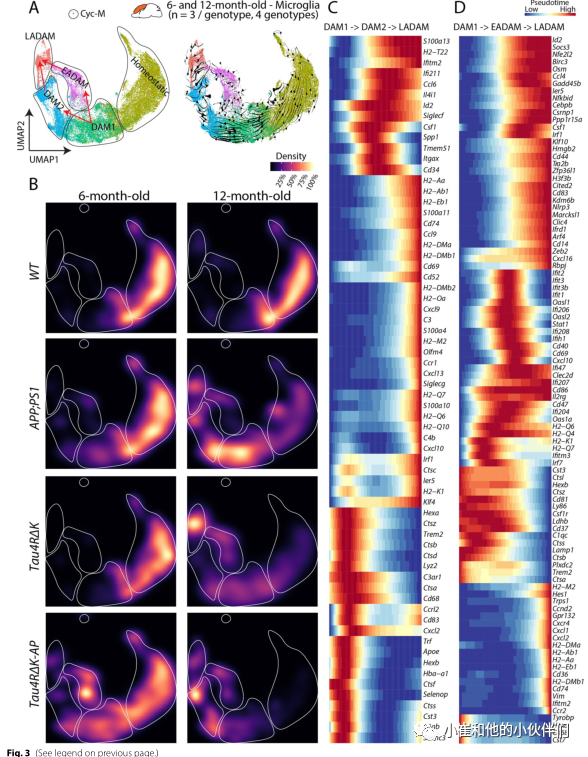
为了阐明EADAM、DAM2和LADAM的出现如何受到Aβ斑块和tau沉积的调控,作者团队合并了6月龄和12月龄样本的小胶质细胞数据集(图3A)。RNA速度分析表明,DAM1很可能导致DAM2 (Aβ斑块驱动)和EADAM (Aβ斑块和tau沉积驱动)产生,而DAM2和EADAM的汇聚可能最终导致LADAM的产生 (图3B)。
此外,RNA速度结合伪时间分析(图3C, D)发现,从DAM1到DAM2再到LADAM的时间进程中多个炎症相关基因发生了变化,如Ccl6、Csf1、Cd34(图3C);以及从DAM1到EADAM再到LADAM的时间进程中干扰素相关基因发生了明显变化,如Ifiti家族成员(图3D)。 在其他神经变性模型中人们也发现了表达干扰素基因和/或MHC II类基因的小胶质细胞簇,然而没有一种疾病模型显示分离的EADAM和LADAM簇的发展呈阶段依赖性。因此作者团队猜测,尽管EADAM或LADAM样亚型可能在神经退行性变和神经炎症中发生,但Aβ斑块和tau沉积的组合对AD疾病分期特异性小胶质细胞亚型的诱导至关重要。
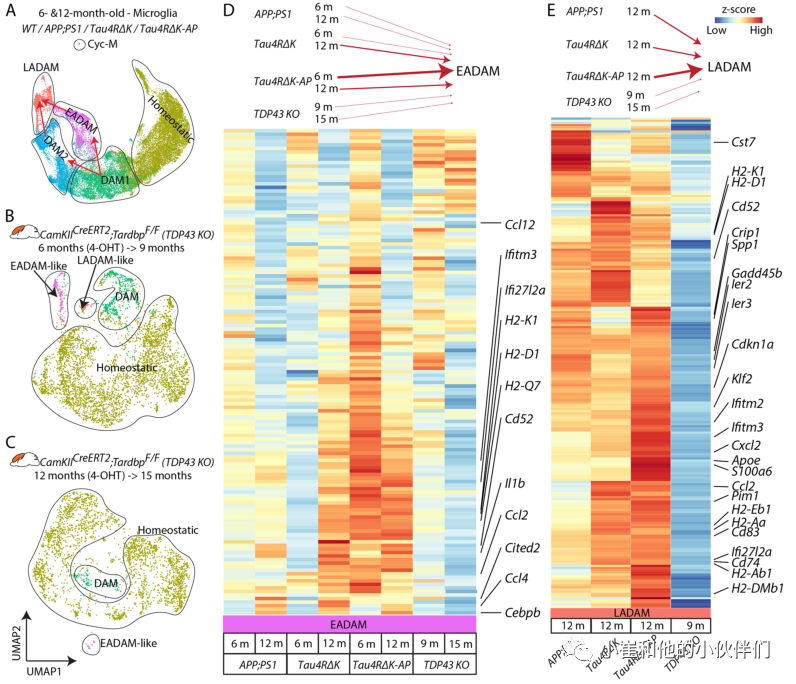
为了验证这一假设,作者团队随后使用另一种神经退行性小鼠模型CamKIICreERT2;Tardbplox/ lox (TDP43 KO),在该模型中,他莫西芬诱导小鼠前脑中TDP-43的条件缺失导致海马CA3神经元的选择性损伤。作者团队从2个不同的TDP43 KO样本的大脑皮层和海马中生成了scRNA-Seq数据,一个在6月龄时被4-OHT(4-羟基他莫昔芬)诱导,在9个月时收集(TDP43 KO6−>9),另一个在12月龄时被4-OHT诱导,在15个月时收集(TDP43 KO12−>15)(图4A-C)。尽管所有的TDP43 KO小鼠都显示出类似DAM1样细胞簇,但TDP43 KO6−>9显示EADAM和LADAM样簇分别选择性表达干扰素基因或MHC II类基因(图4A-C)。TDP43 KO12−>15也显示了EADAM样簇(图4 c),支持EADAM或LADAM样亚型可能发生在整个神经退行性疾病进程的观点。然后作者团队整合了AD小鼠和TDP43 KO小鼠的数据集(图4D, E)。
结果显示,6月龄的APP;PS1和Tau4RΔK-AP小胶质细胞显示了类似的EADAM富集基因表达模式(图4D),但Tau4RΔK-AP小胶质细胞显示这些基因的表达水平比APP;PS1小胶质细胞高得多(图4D)。12月龄的Tau4RΔK和Tau4RΔK-AP小胶质细胞整体表达水平较低,但EADAM表达模式大体相似(图4D)。TDP43 KO小胶质细胞与6月龄的APP;PS1小胶质细胞相似,其EADAM富集基因水平较低(图4D)。LADAM富集基因由DAM2类基因、MHC II类基因和S100a家族基因组成。而TDP43 KO6−>9小胶质细胞中LADAM样簇表达MHC Class II基因,表达水平远低于APP;PS1、Tau4RΔK和Tau4RΔK-AP小胶质细胞(图4E)。在TDP43 KO6−>9小胶质细胞中,也没有检测到任何DAM2样簇,或S100a家族基因。这些结果表明Aβ斑块或tau病理独立诱导了小胶质细胞的特异性基因表达(如EADAM和LADAM),这在其他神经退行性变模型中也可以观察到类似的小胶质细胞簇。神经变性疾病中发生的神经炎症和/或细胞丢失可能是小胶质细胞形成EADAM-或LADAM-like基因表达谱的潜在诱因。
然而,Aβ斑块和tau的联合病理导致在疾病的不同阶段分离的EADAM和LADAM簇其标志基因表达水平更高,并在LADAM中诱导了额外的分子标记物。
04
识别AD样本中阶段特异性EADAM和LADAM特征
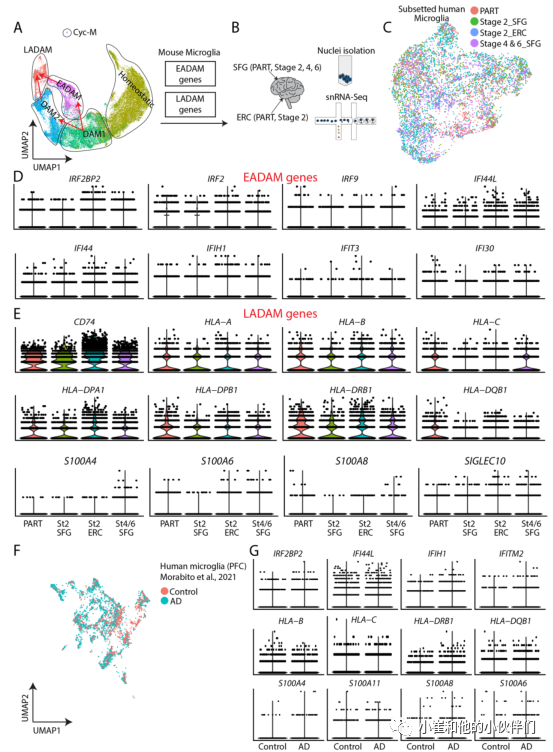
接下来,作者团队从Braak 2期没有tau病理的人类额上回(SFG)和首次检测到AD病理的内嗅皮层(ERC)生成了snRNA-Seq数据集(这些样本与6月龄的Tau4RΔK-AP小鼠具有病理相似性,图5A-C),还从Braak 4期和6期的额上回(SFG)生成了snRNA-Seq(这代表AD的晚期,与12月龄的Tau4RΔK-AP小鼠具有病理相似性)。
另外,作者团队从一种非AD神经退行性疾病、原发性年龄相关性tau病理的ERC和SFG中生成了一个snRNA-Seq数据集(PART) 作为对照(图5A-C)。作者团队初步检查了人类snRNA-Seq数据集中EADAM和LADAM富集基因同源物的表达模式并观察到大多数EADAM富集基因出现在Braak 2期SFG和ERC,而LADAM富集基因出现在Braak 4期和6期SFG。对干扰素诱导基因的表达分析也显示出这些基因表达的一致变化,包括转录因子和协同调控因子IRF2BP2、IRF2和IRF9,它们在Braak期2期ERC的表达高于SFG,在Braak期4/6期SFG的表达水平下降(图5D)。其他干扰素调控基因的表达也有类似的趋势,包括IFI44、IFI44L(图5D)。
作者团队也观察到MHC基因(如HLA-A、HLA-B和HLA-DPA1)的类似趋势,在PART ERC和SFG、Braak 2期ERC和Braak 4/6期SFG的表达水平高于Braak 2期SFG(图5E)。更重要的是,S100基因(如S100A4, S100A11)仅在Braak 4/6期SFG中检测到,而在PART或其他AD snRNA-Seq中未检测到(图5E)。
这一观察结果在来自前额叶皮层的其他高质量人类AD snRNA-Seq中也保持不变(图5F, G)。并且与对照组相比,干扰素调节、MHC和S100家族基因在AD样本中表达更高(图5F, G)。这些发现证实了AD早期出现EADAM相关基因,AD晚期出现LADAM相关基因,提示这些小胶质细胞亚型可能是由Aβ斑块和tau沉积以疾病分期特异性的方式诱导的。
05
Siglecs可作为追踪AD分期特定阶段小胶质细胞亚型的特异性生物标志物
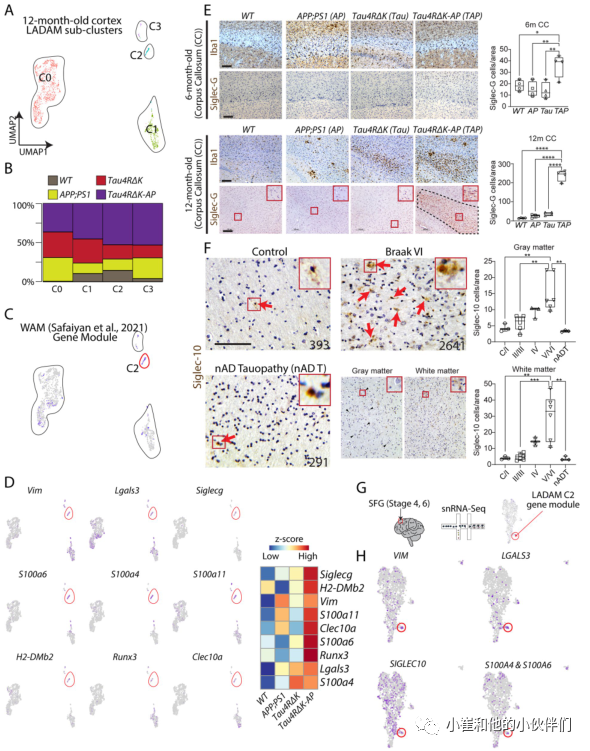
为了进一步鉴定晚期AD特异性基因,作者团队在AD小鼠模型的LADAM簇中鉴定出了4个亚簇(图6A)。尤其是亚簇2和亚簇3,在Tau4RΔK-AP小鼠中表达最为稳健和具有选择性(图6B)。亚簇2是一个由Siglecg标记的LADAM亚簇,也显示出先前报道的在白质相关小胶质细胞(WAM)中表达的基因,如Lgals3, Fam20c, Vim(图6A, C)。在WAM样LADAM中,作者团队还观察到该聚类表达S100a6、S100a4、S100a11、H2-DMb2、Runx2和Clec10a(图6D)。虽然在6月龄的小鼠皮层中也观察到类似WAM的小簇,但这个小簇在12月龄的小鼠皮层中没有表达任何LADAM标记物。与scRNA-Seq的结果一致,作者团队没有在6月龄小鼠的胼胝体中检测到高水平的siglec-G蛋白(图6E)。而在12月龄的Tau4RΔK-AP胼胝体小胶质细胞中则显示出强烈的siglec-G免疫反应信号(图6E)。而且,尽管胼胝体附近的小胶质细胞数量增加,但在相同年龄的APP;PS1和Tau4RΔK小胶质细胞中未能观察到较强的siglec-G免疫反应性信号。
为了证实在AD中的这一发现,作者团队使用针对Siglec-10 (Siglec-G的人类同源基因)的抗体在多个Braak阶段筛查其在AD大脑的表达情况。结果发现,在AD脑内Siglec-10呈Braak分期依赖性积累(图6F),从Braak分期4期开始,在灰质和白质中Siglec-10信号显著增加(图6F)。然而,在非AD的 tau蛋白病患者中Siglec-10信号与健康对照组相似,这也与snRNA-Seq数据一致(图5G, 6F)。为了进一步验证这些观察结果,作者团队检查了Braak 4期和6期SFG的snRNA-Seq数据集(图6G)并观察到一小簇WAM样LADAM,像12月龄Tau4RΔK-AP小鼠(图6H)一样,表达SIGLEC10、S100A6、LGALS3、FAM20C等基因(图6H)。
Siglecs,特别是Siglec10,在AD中富集表达。而在非AD tau蛋白病患者中Siglecs-10 阳性细胞的水平与对照组和低Braak期AD相似(图6F),这一结果表明Siglecs-10可能作为AD的生物标志物和与晚期AD相关的潜在治疗靶点。一些LADAM标记物,特别是MHC II基因,在其他神经退行性变模型中也有表达(图4)。但S100家族基因和Siglecs是晚期AD小胶质细胞所特有的,在动物模型和晚期AD患者大脑中都有表达。这些数据进一步支持了AD特异性LADAM子簇的诱导是Aβ和tau依赖的观点。
小结:
在本研究中,作者团队使用scRNA-Seq对AD小鼠模型中同时出现Aβ和tau病变的小胶质细胞亚型进行了分析。发现在6月龄的Tau4RΔK-AP的早期疾病模型中,Aβ和tau病变的出现诱导了一种新的小胶质细胞亚型EADAM并表达多种干扰素调节基因。在疾病晚期(12月龄的Tau4RΔK-AP小鼠)模型中发现另一种新型小胶质细胞亚型LADAM出现在tau病理反应中并表达MHC和S100家族基因。
作者团队还进一步观察到一种位于白质附近的独特的LADAM亚型,类似于先前确定的白质相关小胶质细胞亚型(WAM)。而疾病分期特异性的EADAM和LADAM的诱导都需要Aβ和tau沉积介导,并可以改变AD病理分期和小胶质细胞亚型的Siglecs信号。这些发现可能对识别新的分子靶点具有重要意义,并为AD症状前生物标志物的开发和治疗策略提供了新的指导。
“
Kim DW, Tu KJ, Wei A, Lau AJ, Gonzalez-Gil A, Cao T, Braunstein K, Ling JP, Troncoso JC, Wong PC, Blackshaw S, Schnaar RL, Li T. Amyloid-beta and tau pathologies act synergistically to induce novel disease stage-specific microglia subtypes. Mol Neurodegener. 2022 Dec 17;17(1):83. doi: 10.1186/s13024-022-00589-x.






