Cell重磅:揭秘干细胞是如何形成人类大脑的
人类的大脑就像是一件精心设计的艺术品,它拥有相当复杂的结构——由数百亿个具有不同身份的细胞组成。这就像是一场由数百亿位音乐家完成的复杂交响乐,每个细胞都执行着重要的功能,缺少其中一环都可能导致这个精密系统的崩溃。
人类的大脑就像是一件精心设计的艺术品,它拥有相当复杂的结构——由数百亿个具有不同身份的细胞组成。这就像是一场由数百亿位音乐家完成的复杂交响乐,每个细胞都执行着重要的功能,缺少其中一环都可能导致这个精密系统的崩溃。
这也提出了一个疑问,人类大脑究竟是如何决定这些细胞的发育命运的?为了揭示这个未解之谜,斯坦福大学的干细胞生物学家 Irving Weissman 和 Daniel Dan Liu 等人开发了一项新技术,可以分离、分析单个脑细胞的转录组和功能特征,以此揭示干细胞形成人脑的过程。
2023年3月16日,该研究以:Purification and characterization of human neural stem and progenitor cells 为题,发表于国际顶尖学术期刊 Cell 上。

人脑固然是拥有复杂的功能和结构,但也不要忘记这数百个亿个细胞其实都来源同一类细胞——神经干细胞(NSCs)。在发育中的大脑皮层中,放射状胶质细胞(RG)可以作为神经干细胞,自我更新并逐渐产生更多谱系的祖细胞,最终产生三个主要的神经谱系:神经元、少突胶质细胞和星形胶质细胞。
近年来,单细胞技术的发展为神经干细胞和神经祖细胞(NSPCs)在整个发育过程中的转录组多样性提供了前所未有的空间和时间分辨率,从而产生了人类NSPCs的详细图谱。然而,虽然转录组特征在识别细胞类型和特征方面有很大的用途,但干细胞最终应该由它们的功能来定义,特别是关于自我更新和分化潜力。
干细胞生物学的本质在于能够前瞻性地分离纯细胞群进行功能表征,例如保证可靠的组织分离和细胞表面标记,以及用于纯化和评估其自我更新和分化的体内特性。
在这项最新研究中,Irving Weissman 和 Daniel Dan Liu 等开发了一种通过荧光激活细胞分选(FACS)纯化不同NSPC亚群的方法,允许基于十多种细胞表面标记物的定量表达进行前瞻性分离。
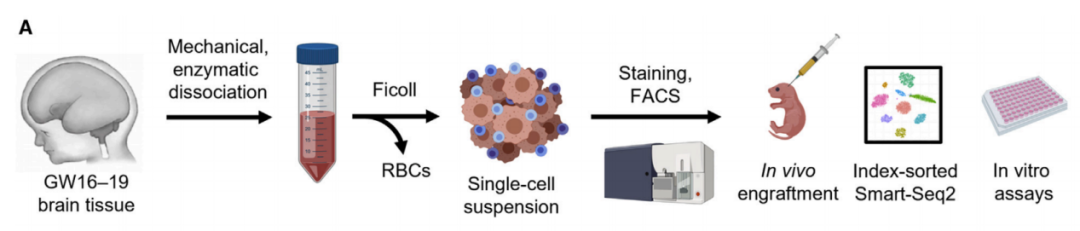
研究流程图
具体而言,研究团队将高维流式细胞术与单细胞转录组学相结合,全面纯化和功能表征了妊娠中期发育中的人脑中的神经干细胞和不同的下游神经祖细胞亚群(GW17-19)。与此同时,研究团队还利用基于细胞表面标记物组合表达(免疫表型)的指数排序,直接将表面标记物表达与单细胞表达的转录组联系起来,允许严格验证排序纯度。

从发育中的人脑中分离出NSPCs
基于此,研究团队从17-19周大的人类胎儿中分离出脑细胞,并对细胞表面的11种蛋白质进行了测试,其中包括6种与神经细胞发育有关的蛋白质。此外,他们还分析了RNA水平作为基因活性的衡量标准,并利用这些信息纯化了10种可能产生星形胶质细胞、少突胶质细胞和神经元的细胞。然后,研究团队将纯化后的细胞注入小鼠大脑,并在6个月后分析了这些细胞及其后代的位置迁移,以及它们新获的细胞身份。
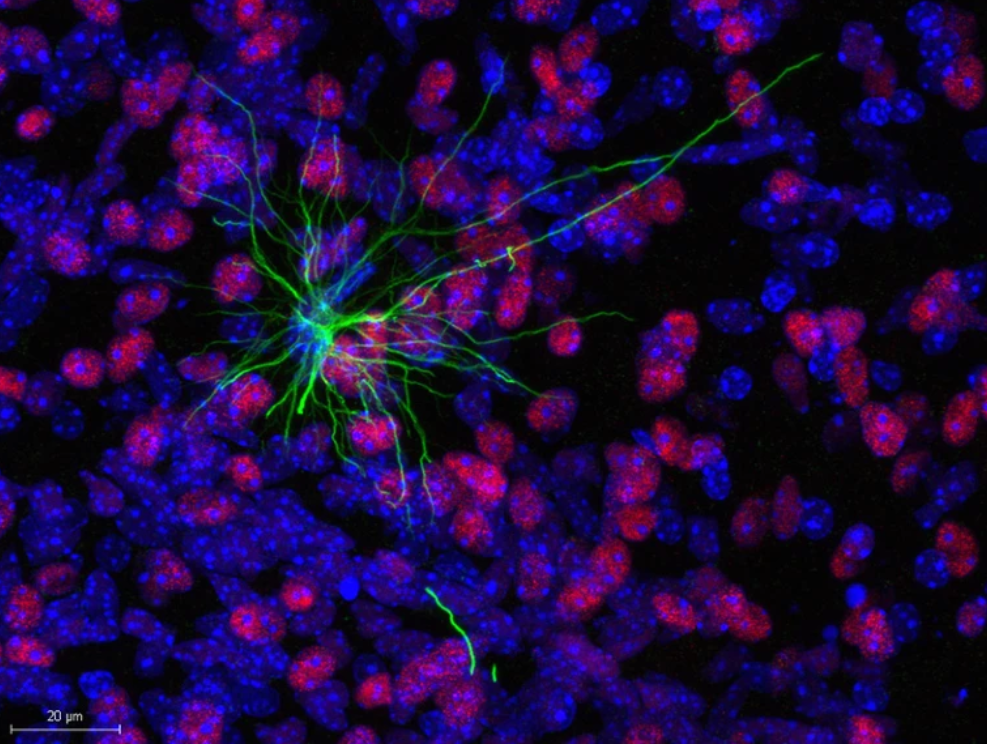
人类神经干细胞产生的人类星形胶质细胞(绿色)在小鼠大脑(红色和蓝色)中生长
研究结果显示,这种新的技术组合在组织处理和分选策略上允许同时纯化10个定义的NSPC亚群,包括放射状胶质细胞(RG)、神经元前体、少突胶质细胞前体和星形胶质细胞谱系细胞,并可以证明这些NSPC亚群在体外和体内的功能特性。
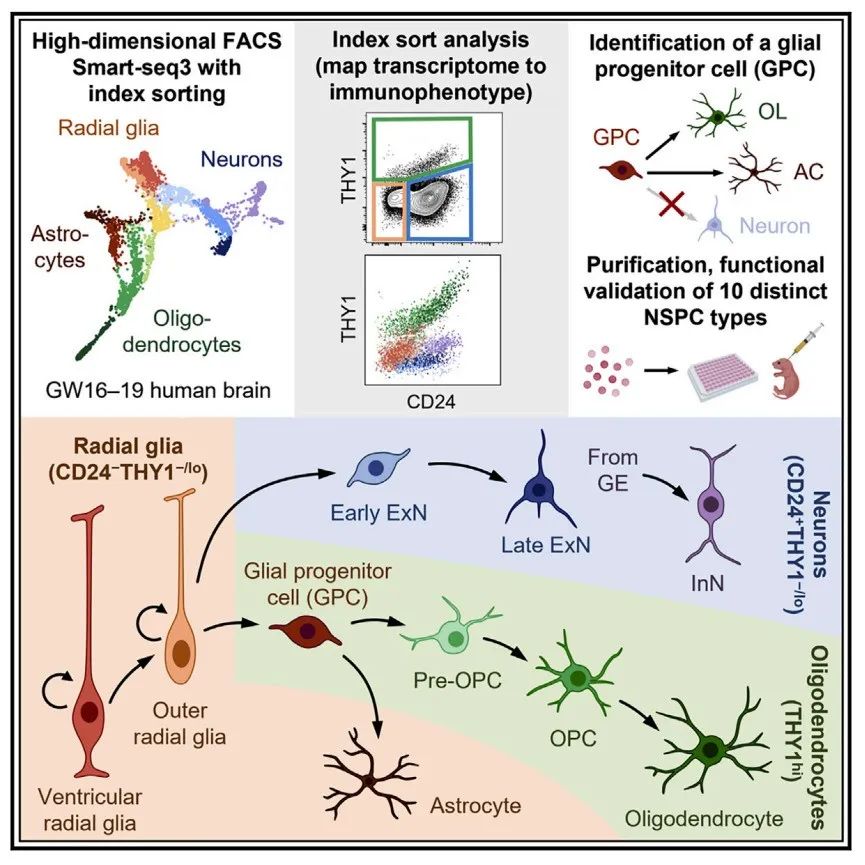
研究模式图
通过这项新技术,研究团队确定了一种在转录组上独特的双能神经胶质祖细胞(GPC),这类细胞只产生星形胶质细胞和少突胶质细胞。有意思的是,小鼠大脑中的GPC细胞比人类大脑更稀疏,Daniel Dan Liu 认为这种特殊的细胞类型可能对灵长类动物大脑的特定适应很重要。
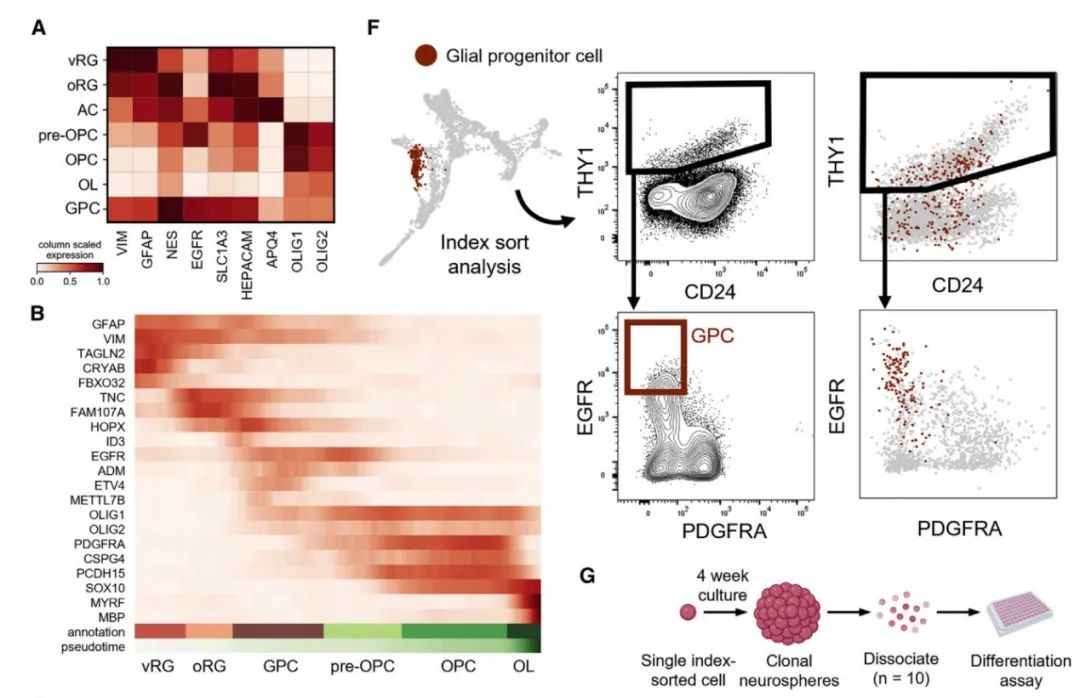
双能神经胶质祖细胞(GPC)的鉴定
此外,研究团队还发现,一种名为Thy1的蛋白质的高水平表达与少突胶质细胞谱系有关,这与以前的发现背道而驰,此前的研究认为Thy1是神经元而不是少突胶质细胞的分子标记。当然,这种差异也可能是新方法提高了不同细胞类型的分辨率的结果,因此这项技术也可能对研究其他种类的干细胞十分有用。
原始出处:
Daniel Dan Liu, et al.Purification and characterization of human neural stem and progenitor cells. Cell, 2023.






