《自然·免疫学》:找到“反卷”T细胞!缺氧可让耗竭T细胞产生免疫抑制效果
当T细胞加班加点地对抗肿瘤时,它们会进入一种精疲力竭的状态(T细胞耗竭),不再正常工作。在之前的认知中,大家大多觉得T细胞只是自身躺平了而已,而最近的这项研究发现,在肿瘤缺氧的环境中,终末耗竭的T细胞还会化身叛徒,阻止其他的T细胞卷。 来自美国匹兹堡大学免疫学系的Greg M. Delgoffe团队在《自然免疫学》期刊发表重要研究成果,他们发现缺氧可以增强终末耗竭T细胞上CD39的表达,从而制造
当T细胞加班加点地对抗肿瘤时,它们会进入一种精疲力竭的状态(T细胞耗竭),不再正常工作。在之前的认知中,大家大多觉得T细胞只是自身“躺平”了而已,而最近的这项研究发现,在肿瘤缺氧的环境中,终末耗竭的T细胞还会“化身叛徒”,阻止其他的T细胞“卷”。
来自美国匹兹堡大学免疫学系的Greg M. Delgoffe团队在《自然·免疫学》期刊发表重要研究成果,他们发现缺氧可以增强终末耗竭T细胞上CD39的表达,从而制造出一种免疫抑制微环境,来抑制其他T细胞的功能[1]。这一发现拓展了我们对耗竭性T细胞的认知,并可能为肿瘤免疫治疗带来新的思路。

论文首页截图
在肿瘤中,T细胞会表现出一种“耗竭”的异常功能状态。先前的研究已经知道,CD8 T细胞的耗竭不是一个单一的状态,其中表达转录因子TCF-1的耗竭前体T细胞(pTex)具有自我更新能力,并可以进一步变为不表达TCF-1的终末耗竭T细胞(tTex)[2]。
肿瘤中tTex细胞的富集往往和较差的免疫检查点抑制剂治疗反应相关[3,4]。之前的研究大多认为这是T细胞功能丧失的结果,而Greg M. Delgoffe团队却猜测,会不会不仅是T细胞本身耗竭了,它们还促进了免疫抑制性肿瘤微环境的形成呢?
大家知道,Treg细胞发挥着免疫抑制功能。Greg M. Delgoffe团队发现,随着CD8 T细胞走向终末耗竭,tTex细胞会倾向于上调Treg细胞相关的基因。
为了确定肿瘤中的tTex细胞是否确实具有抑制功能,研究人员将B16-F10黑色素瘤小鼠的Treg细胞以及耗竭性T细胞分选出来,与其他T细胞进行共培养。结果发现,tTex和Treg细胞对共同培养的T细胞有着类似的抑制作用,而pTex细胞则没有表现出抑制能力。
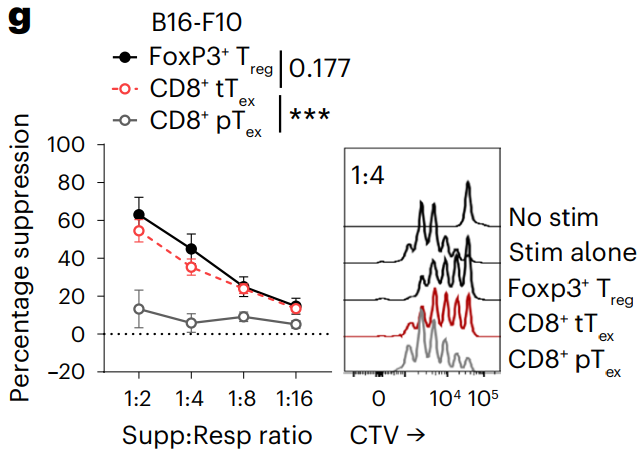
终末耗竭T细胞(Tex)和Treg细胞对共培养的T细胞有着类似的抑制作用,而耗竭前体T细胞(pTex)没有表现出抑制能力。
此外,研究人员还在其他免疫治疗不敏感的肿瘤模型(例如Clone24,MEER模型)中验证了这一发现。然而有趣的是,从免疫检查点抑制剂治疗敏感的MC38结肠癌小鼠肿瘤中分离的tTex并没有表现出抑制功能。这些数据提示,tTex细胞所处的环境可能对它的抑制功能有着关键作用。
那么,tTex细胞是如何发挥抑制功能的呢?
Treg细胞可以通过分泌IL-10来发挥抑制作用,先前也有研究发现了一群分泌IL-10的CD8 T细胞[5]。然而Il10敲除的tTex细胞与野生型tTex细胞有着相似的抑制功能,说明tTex细胞并非通过IL-10发挥抑制功能。
先前的研究还表明,Treg细胞上高表达的CD39和CD73可以将凋亡细胞释放的ATP水解为腺苷,从而发挥抑制功能[6]。在人和小鼠的肿瘤中,CD39可以作为终末耗竭CD8 T细胞的标志分子[7, 8]。Greg M. Delgoffe团队发现,tTex细胞上CD39的表达水平与其抑制功能表现出正相关。
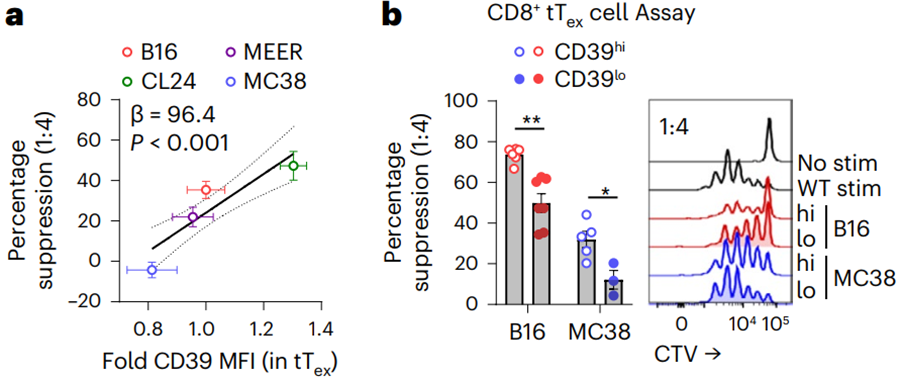
tTex细胞上CD39的表达水平与抑制能力正相关。
但是与Treg细胞不同的是,CD8 tTex细胞虽然会高表达CD39,但并不会同时高表达CD73。因此,研究人员推测tTex细胞上表达的CD39,可能和周围其他细胞上表达的CD73一起产生腺苷,从而制造免疫抑制的微环境。
为了证明这一猜测,研究人员从CD73敲除小鼠中分离出T细胞和抗原呈递细胞,并与野生型tTex细胞共培养,结果发现tTex细胞的抑制能力显著降低。此外,敲除T细胞的CD39可以使tTex细胞的抑制功能完全丧失,并可以减缓肿瘤生长。在效应T细胞中过表达CD39可以抑制自身和邻近T细胞的功能。
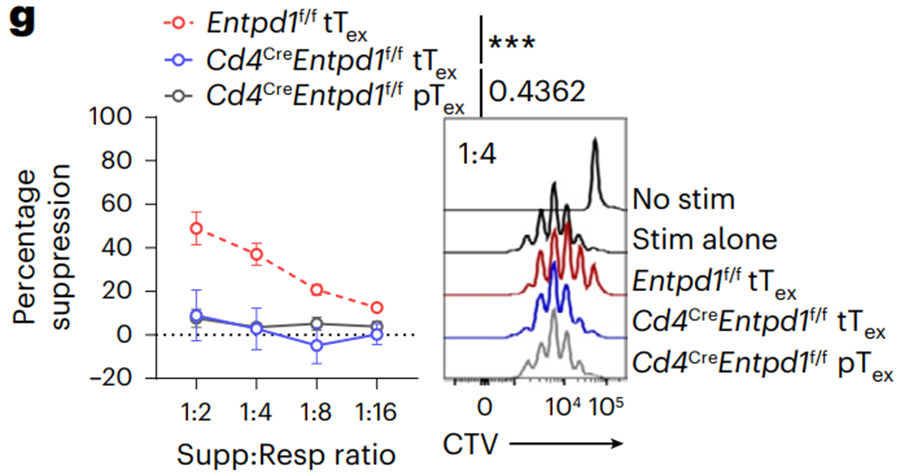
敲除T细胞上的CD39(Entpd基因)可以使tTex细胞的抑制功能完全丧失。
基于这些发现,研究人员又进一步探究了靶向CD39在肿瘤治疗中的作用。他们发现,CD8 T细胞中CD39的缺失本身可以在一定程度上减缓肿瘤进展。
更有意思的是,在CD39缺失的情况下,免疫检查点抑制剂的治疗效果得到显著增强,肿瘤浸润T细胞的效应功能也得到显著提高。这提示靶向抑制CD39介导的免疫抑制通路可以重新激活抗肿瘤免疫反应,并可增强肿瘤免疫治疗的效果。
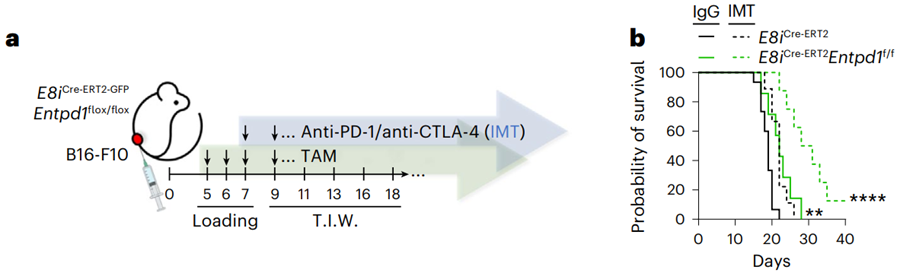
敲除CD39可以增强免疫检查点抑制剂的治疗效果。
先前的研究表明,缺氧、氧化应激和促炎介质均可诱导CD39的表达[9]。Greg M. Delgoffe团队发现,相比于pTex细胞,tTex细胞经历了明显的缺氧,且缺氧程度与细胞表面CD39的表达正相关。体外培养也发现,在缺氧条件下培养的CD8T细胞表达更高水平的CD39,而敲除缺氧诱导因子-1(Hif1α)可以阻止CD39的升高。
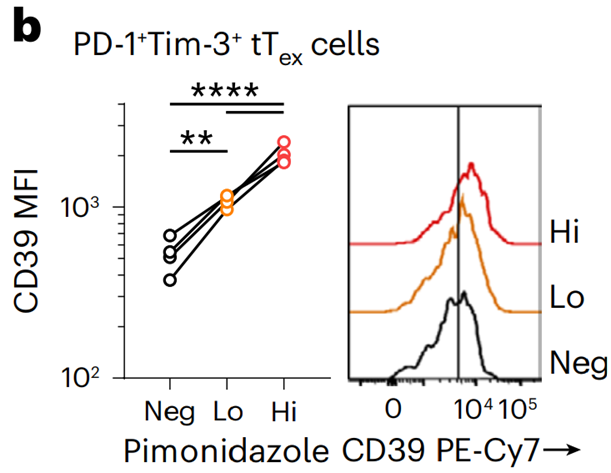
CD39的表达与缺氧程度正相关。
前面我们提到MC38肿瘤浸润的tTex细胞大多是非抑制性的,而这些tTex细胞大多也低表达CD39,且与B16-F10等其他肿瘤相比,这些tTex细胞所处环境的缺氧程度也更低。此外,敲除肿瘤细胞的线粒体复合体I亚基Ndufs4可以显著降低肿瘤缺氧程度,在Ndufs4敲除的B16-F10肿瘤中浸润的tTex细胞也表现出较低的CD39表达。
Greg M. Delgoffe团队之前的研究发现,阿昔替尼和二甲双胍可以使缺氧肿瘤对免疫检查点抑制剂变得敏感。在本研究中,他们进一步发现阿昔替尼和二甲双胍可以降低肿瘤缺氧程度,并可降低tTex细胞上CD39的表达水平,进而降低tTex细胞的免疫抑制功能。这些结果提示,改善肿瘤的缺氧环境,也可能成为增强肿瘤免疫反应的潜在新策略。
总的来说,这项研究发现肿瘤中终末耗竭的T细胞不仅表现出功能障碍,还会表现出免疫抑制的作用。肿瘤的缺氧环境可以诱导tTex细胞上CD39的表达,进而参与腺苷代谢来制造免疫抑制微环境。通过靶向肿瘤缺氧或CD39的活性,可以减弱tTex细胞的抑制功能,这一发现可能为肿瘤免疫治疗带来新的思路。
参考文献
[1] P.D.A. Vignali, K. DePeaux, M.J. Watson, C. Ye, B.R. Ford, K. Lontos, N.K. McGaa, N.E. Scharping, A.V. Menk, S.C. Robson, A.C. Poholek, D.B. Rivadeneira, G.M. Delgoffe, Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity, Nat Immunol, (2022).
[2] I. Siddiqui, K. Schaeuble, V. Chennupati, S.A. Fuertes Marraco, S. Calderon-Copete, D. Pais Ferreira, S.J. Carmona, L. Scarpellino, D. Gfeller, S. Pradervand, S.A. Luther, D.E. Speiser, W. Held, Intratumoral Tcf1(+)PD-1(+)CD8(+) T Cells with Stem-like Properties Promote Tumor Control in Response to Vaccination and Checkpoint Blockade Immunotherapy, Immunity, 50 (2019) 195-211.e110.
[3] B.C. Miller, D.R. Sen, R. Al Abosy, K. Bi, Y.V. Virkud, M.W. LaFleur, K.B. Yates, A. Lako, K. Felt, G.S. Naik, M. Manos, E. Gjini, J.R. Kuchroo, J.J. Ishizuka, J.L. Collier, G.K. Griffin, S. Maleri, D.E. Comstock, S.A. Weiss, F.D. Brown, A. Panda, M.D. Zimmer, R.T. Manguso, F.S. Hodi, S.J. Rodig, A.H. Sharpe, W.N. Haining, Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade, Nat Immunol, 20 (2019) 326-336.
[4] M. Sade-Feldman, K. Yizhak, S.L. Bjorgaard, J.P. Ray, C.G. de Boer, R.W. Jenkins, D.J. Lieb, J.H. Chen, D.T. Frederick, M. Barzily-Rokni, S.S. Freeman, A. Reuben, P.J. Hoover, A.C. Villani, E. Ivanova, A. Portell, P.H. Lizotte, A.R. Aref, J.P. Eliane, M.R. Hammond, H. Vitzthum, S.M. Blackmon, B. Li, V. Gopalakrishnan, S.M. Reddy, Z.A. Cooper, C.P. Paweletz, D.A. Barbie, A. Stemmer-Rachamimov, K.T. Flaherty, J.A. Wargo, G.M. Boland, R.J. Sullivan, G. Getz, N. Hacohen, Defining T Cell States Associated with Response to Checkpoint Immunotherapy in Melanoma, Cell, 175 (2018) 998-1013.e1020.
[5] Y. Zhao, H. Zhao, Y. Sun, J. Hao, X. Qi, X. Zhou, Z. Wu, P. Wang, S.M. Kaech, C.T. Weaver, R.A. Flavell, L. Zhao, Z. Yao, Z. Yin, IL-4 induces a suppressive IL-10-producing CD8+ T cell population via a Cdkn2a-dependent mechanism, J Leukoc Biol, 94 (2013) 1103-1112.
[6] S. Deaglio, K.M. Dwyer, W. Gao, D. Friedman, A. Usheva, A. Erat, J.F. Chen, K. Enjyoji, J. Linden, M. Oukka, V.K. Kuchroo, T.B. Strom, S.C. Robson, Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression, J Exp Med, 204 (2007) 1257-1265.
[7] P.K. Gupta, J. Godec, D. Wolski, E. Adland, K. Yates, K.E. Pauken, C. Cosgrove, C. Ledderose, W.G. Junger, S.C. Robson, E.J. Wherry, G. Alter, P.J. Goulder, P. Klenerman, A.H. Sharpe, G.M. Lauer, W.N. Haining, CD39 Expression Identifies Terminally Exhausted CD8+ T Cells, PLoS Pathog, 11 (2015) e1005177.
[8] F.P. Canale, M.C. Ramello, N. Nunez, C.L. Araujo Furlan, S.N. Bossio, M. Gorosito Serran, J. Tosello Boari, A. Del Castillo, M. Ledesma, C. Sedlik, E. Piaggio, A. Gruppi, E.A. Acosta Rodriguez, C.L. Montes, CD39 Expression Defines Cell Exhaustion in Tumor-Infiltrating CD8(+) T Cells, Cancer Res, 78 (2018) 115-128.
[9] P. Jayaprakash, P.D.A. Vignali, G.M. Delgoffe, M.A. Curran, Hypoxia Reduction Sensitizes Refractory Cancers to Immunotherapy, Annu Rev Med, 73 (2022) 251-265.






