胡新央:IABP术后抗凝,所有患者都必须使用吗?
主动脉内球囊反搏(IABP)是一种有效的循环辅助手段,自开始临床应用已有半个世纪,全球约有几百万例患者接受过IABP辅助治疗,且随着技术的进步、反搏装置及气囊导管的不断改进,IABP在临床的应用将会越来越多。掌握正确的IABP应用时机和并发症防治,是安全应用IABP辅助支持作用的关键;而在当前IABP是否应常规抗凝治疗尚无明确定论的情况下,根据患者具体情况个体化抗凝,亦是实现不良事件风险最小化的
主动脉内球囊反搏(IABP)是一种有效的循环辅助手段,自开始临床应用已有半个世纪,全球约有几百万例患者接受过IABP辅助治疗,且随着技术的进步、反搏装置及气囊导管的不断改进,IABP在临床的应用将会越来越多。掌握正确的IABP应用时机和并发症防治,是安全应用IABP辅助支持作用的关键;而在当前IABP是否应常规抗凝治疗尚无明确定论的情况下,根据患者具体情况个体化抗凝,亦是实现不良事件风险最小化的关键。在今年举行的第七届冠心病学科交叉暨介入治疗大会(CMIT)暨冠心病影像与功能学大会(CIFC)期间,浙江大学医学院附属第二医院胡新央教授结合大量的循证医学证据,围绕IABP术后是否常规抗凝或如何抗凝进行了详细阐述。
IABP特点及临床应用
CMIT 2021 ONLINE
作为一种搏动泵辅助装置,IABP具有操作简单、安全性较高、费用相对低廉等优势,是我国目前应用最广泛的机械循环辅助装置。根据《经皮机械循环辅助临床应用及管理中国专家共识(2020)》,IABP适应证包括:急性心肌梗死合并严重心衰或心原性休克、AMI机械并发症(如乳头肌功能失调或断裂、室间隔穿孔等)、难治性心绞痛、高危经皮冠脉介入治疗围术期支持、心脏移植前过渡等。
尽管因IABP-SHOCK II等研究阴性结果的影响,近年来IABP推荐级别有所降低,但当前国内相关指南依旧支持IABP临床应用,尤其对于血流动力学不稳定的患者;在心原性休克患者循环辅助装置的使用上,建议在无ECMO和LVAD条件的情况下,应尽快置入IABP,强调早期置入和使用充足的时间。其中,《心原性休克诊断和治疗中国专家共识(2018)》建议,对于STEMI合并心原性休克患者,当药物治疗后血流动力学仍不能迅速稳定者,可用IABP支持(IIa,B);《中国经皮冠状动脉介入治疗指南(2016)》亦指出,对于急性冠脉综合征合并机械性并发症患者,发生血流动力学不稳定或心原性休克时可置入IABP(IIa,C)。
IABP术后同时存在缺血和出血风险
CMIT 2021 ONLINE
通过IABP治疗能够改善患者心输出量,显着降低氧耗,增加心肌氧供应,改善患者预后,但值得注意的是,IABP治疗期间也会伴随着肢体缺血、出血、动脉穿孔、血小板减少等并发症。其中,肢体缺血的主要原因包括斑块脱落、血栓形成、动脉损伤、导管阻断血流、抗凝治疗不当及IABP停搏时间过长等。IABP导致血栓栓塞的机制可分为:动脉管腔内涡流形成,涡流的离心作用导致血小板聚集;球囊拍击导致粥样斑块碎裂脱落;球囊导管末端血栓形成,栓子脱落;部分患者存在高凝状态。
与IABP术后缺血相关的危险因素较多,大球囊导管、外周血管疾病以及休克等均与患者IABP缺血并发症的发生密切相关。早在1987年,一项发表于JACC杂志的研究显示,当使用12/10.5 F这种大球囊导管行IABP时,约43%患者会出现临床明显的肢体缺血。如果改用小球囊导管,是否会对IABP术后缺血风险的降低带来助力引起了研究人员的兴趣。2002年公布的Benchmark注册研究对此做出了一定解答(图1),该结果显示与9.5 F球囊导管组相比,8.0 F球囊导管的使用在不影响出血的情况下,可显着降低患者的肢体缺血发生率,且缺血高风险患者的获益最为显着。一些研究亦提示,与有鞘导管相比,无鞘导管的使用也可显着降低IABP术后缺血发生率,这一系列研究结果的公布势必对IABP辅助治疗的开展提供极大的指导作用。
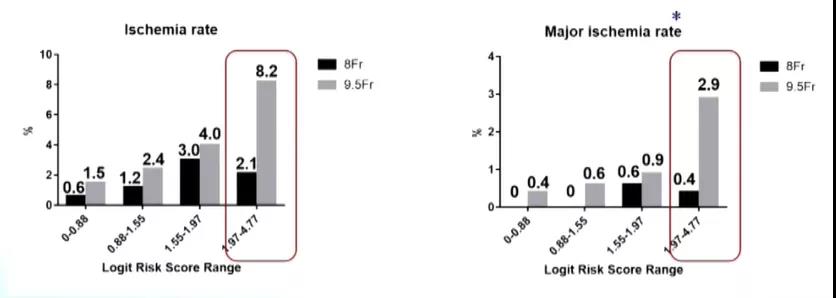
图1. Benchmark注册研究—小球囊导管降低肢体缺血发生率,高风险组获益最明显
除缺血风险的增加之外,IABP术后也存在着出血风险。早在1998年,Vonderheide等通过一项随机对照研究发现,在两组患者肝素使用无差异的情况下,与未使用IABP的患者相比,使用IABP组血小板数量存在明显降低,而当IABP拔出之后,患者血小板数量又逐渐开始恢复。事实上,在临床实践中,IABP术后血小板减少发生率并不低,且因血小板在出血凝血过程中发挥着重要作用,IABP术后所带来的血小板数量降低,某种程度上可能会增加患者的出血风险。2021年发表于J Geriatr Cardiol杂志的一项研究显示(图2),710例患者中共249例患者(35.07%)出现血小板减少,相较于血小板数量正常的患者,IABP术后发生血小板减少患者出血发生率以及输血比例更高,且经倾向匹配评分筛选之后,IABP术后发生血小板减少患者组出血发生率比例依旧较高。
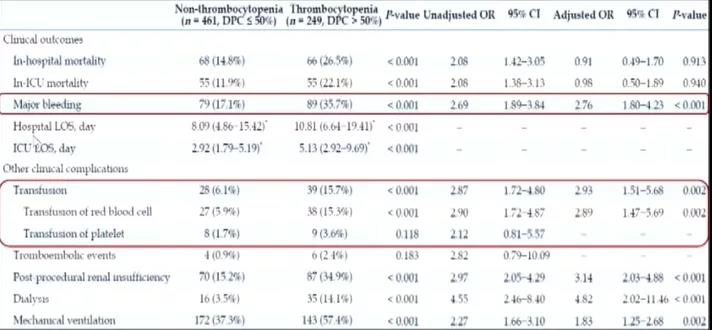
图2. IABP术后发生血小板减少患者出血发生率及输血比例更高
IABP本身不是抗凝绝对指征
CMIT 2021 ONLINE
在IABP置入后,患者血栓风险及出血风险均会增加,在两种风险并存的情况下,是否应采取抗凝治疗或者应如何进行抗凝管理,引起了广大临床医师的关注与思考,一系列相关研究相继涌现。2003年公布了一项由王建安教授所牵头的前瞻性研究,该项研究共纳入153例IABP患者,随机分为抗凝组和非抗凝组,所有患者除接受常规的实验室检查外,且于即刻、24 h、48 h和IABP拔出后的24 h测定血小板计数、D-二聚体、PAI-1、FDP等血液学指标以及肢体缺血、出血、IABP表面血栓等临床指标,最终结果显示,非抗凝组82例患者中仅发生2例一般肢体缺血,而抗凝组71例中也发生了3例肢体缺血,两组间不存在统计学差异,IABP期间不常规使用肝素抗凝并不增加IABP引起的肢体缺血发生率,同时两组IABP表面均无血凝块形成,但抗凝组出血发生率更高。此外,2021年所公布的一项真实世界的临床研究亦对IABP常规不需抗凝治疗作出了一定验证。Julie Kelloy教授等将147例患者分为肝素抗凝组及非肝素抗凝组,结果显示两组出血与栓塞并发症均无明显差异,且在排除入院前已在抗凝治疗患者的基础上进一步亚组分析显示,两组出血与栓塞并发症发生率仍无差异(图3)。
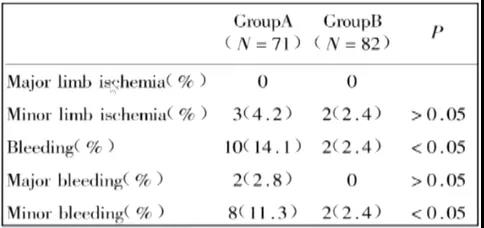
图3. 抗凝 vs.未抗凝—两组肢体缺血发生率无差异,抗凝组出血发生率更高
在探索IABP辅助期间是否应常规抗凝的同时,围绕着“普遍抗凝 vs.选择性抗凝”这一方向也开展了系列研究。2008年于Acute Card Care杂志发表了一项单中心观察性研究结果(图4),该研究将IABP患者随机分为普遍肝素抗凝组(目标PTT 1.5-2.5倍正常值)和选择性肝素抗凝组。在选择性肝素抗凝组,当患者存在再血管化的急性冠脉综合征、大面积前壁心梗、心内血栓、房颤等时予以抗凝治疗(53%接受肝素处理)。结果显示,两组肢体缺血、穿刺位点出血发生率无显着性差异,但选择性抗凝组非穿刺位点大出血发生率却远低于普遍抗凝组,另外经多元逻辑回归分析提示,普遍肝素抗凝是大出血和肢体出血的重要危险因素。
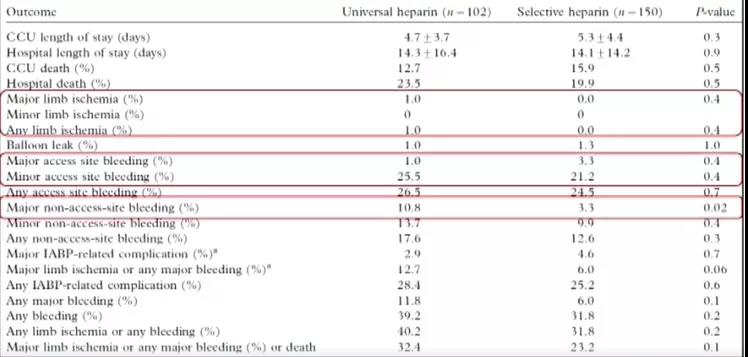
图4. 普遍抗凝 vs.选择性抗凝—肢体缺血无差异,但选择性抗凝组非穿刺点大出血发生率低
根据既往调查结果,抗凝预防IABP引起的肢体缺血是国内外许多医学中心的常规措施,但从上述研究结果可知,普遍抗凝不仅未带来缺血风险降低的临床获益,反而使得可出血风险进一步增加。在IABP术后是否应常规抗凝尚无定论的背景下,2015 SCAI/ACC/HFSA/STS机械循环辅助临床专家共识对于这一问题并未给予明确推荐,仅指出IABP术后是否需要抗凝当前每个中心有所不同,未来仍需更多循证医学证据的支持。
相比之下,《主动脉内球囊反搏心脏外科围手术期应用专家共识2017》则给出了较为具体的指导意见,该指南推荐IABP患者采用有选择的抗凝方案,对于围手术期心肌缺血、房颤、瓣膜置换以及存在血栓形成高危患者,如存在外周血管病变、女性以及高龄的患者给予静脉肝素或低分子肝素抗凝,同时应密切观察有无出血等并及时调整肝素剂量,必要时停用,长期应用IABP患者可选择华法林抗凝。
总结
CMIT 2021 ONLINE
IABP术后同时存在栓塞和出血风险;令人欣喜的是,随着IABP材料的改进、技术进步,IABP相关并发症发生率有所降低;IABP本身不是抗凝绝对指征,IABP术后是否抗凝应根据患者有无其他抗凝指征进行个体化决策。






