HIV感染儿童队列中早期治疗的临床特征、病毒学和免疫学亚表型
背景:人人类免疫缺陷病毒(HIV-1)的治愈代表了前所未有的科学挑战。尽管抗逆转录病毒疗法(ART)成功降低了HIV-1病毒感染者的发病率和死亡率,但它未能清除HIV1感染。HIV-1病毒的恢复能力,以及病毒的高突变率、耐药性和无法产生中和抗体是必须克服的主要困难。 在初次感染后不久,建立了包含整合的HIV-1 DNA的长寿、休眠记忆CD4细胞库。与成人相比,由于婴儿的记忆细胞数量有限,早期治疗
背景:人人类免疫缺陷病毒(HIV-1)的治愈代表了前所未有的科学挑战。尽管抗逆转录病毒疗法(ART)成功降低了HIV-1病毒感染者的发病率和死亡率,但它未能清除HIV1感染。HIV-1病毒的恢复能力,以及病毒的高突变率、耐药性和无法产生中和抗体是必须克服的主要困难。
在初次感染后不久,建立了包含整合的HIV-1 DNA的长寿、休眠记忆CD4细胞库。与成人相比,由于婴儿的记忆细胞数量有限,早期治疗围产期感染的婴儿可能是清除HIV-1 DNA的最佳机会,已经提出了几种策略来清除这些患者的病毒。然而,疫苗或治疗方法的成功是有限的,并且在患者中差异很大。找到原因是一个巨大的挑战。答案可能在于病毒的巨大多样性和患者宿主免疫背景的可变性。已经做了大量的工作来确定与儿童HIV-1水库大小相关的主要因素。基线病毒血症和复制能力、宿主免疫背景、早期治疗和免疫激活与HIV-1水库大小相关。然而,这些决定因素中的每一个都与微小的影响有关,并且单独地不能有效地预测储层的大小。
在过去的几年中,已经建立了多学科联盟来研究储库和对HIV的复杂免疫反应。其中一个联盟是EPIICAL项目(早期治疗围产期感染艾滋病毒的个体:用新的免疫治疗策略改善儿童的实际生活),该项目旨在建立一个预测性的体外和体内平台,为导致艾滋病毒缓解的治疗策略提供信息。通常,在儿科艾滋病毒中,这些联盟研究提供了来自小样本量的高维度信息。结果创建并填充了大量数据库。积累大量生物信息和模拟复杂变量相互作用的好处和挑战比以往任何时候都更加明显。整合多水平信息可以降低预测模型的复杂性,并为识别临床相关的HIV-1亚型提供了独特的机会。与其他疾病领域一样,在艾滋病毒领域,迫切需要揭示整合了免疫、病毒学和临床信息的亚型,从而实现个性化HIV-1药物。在概念验证试验中,不同的表型可能对不同的疗法有不同的反应。在未来,我们也许能够为寻求治愈之路的HIV-1感染儿童设计定向的、个体化的治疗方法。
目的:在这项研究中,我们的目的是根据早期治疗的围产期获得性HIV-1儿童和青少年队列中患者的临床、病毒学和免疫学特征来识别和表征儿科亚型。
方法:我们收集了临床和社会人口数据,基线病毒载量(VL), CD4和CD8计数和百分比,ART起始年龄,外周血单个核细胞(PBMCs)中的HIV DNA库大小,细胞相关RNA (CA-RNA),超敏感VL, CD4亚群(T效应CD25+,激活的记忆细胞,Treg细胞),体液特异性HIV反应(T-bet B细胞),先天反应(CD56dim natural killer (NK)细胞,NKp 46+,穿孔素),衰竭标志物(PD-1, PD-L1, DNAM),CD8衰老,t淋巴细胞胸腺输出(TREC)和内皮激活(VCAM)的生物标志物。在稀疏聚类中使用无监督的套索型惩罚选择来选择最有信息的变量。以Pearson相关为距离度量,WARD进行层次聚类。聚类方法为D2。应用内部验证来选择最佳的簇数。采用箱线图和Kruskal Wallis检验比较聚类间的特征。
结果:共发现3个亚表型(cluster1: n= 18.45%;cluster2: n = 11, 27.5%;cluster3: n = 11, 27.5%)。与其他聚集群的患者相比,聚集群1的患者较早接受治疗,具有较高的基线%CD4、较低的HIV病毒库大小、较低的western blot评分、较高的TREC值和较低的VCAM值。相比之下,cluster3则不那么有利。患者接受治疗较晚,预后较差,CD4 %较低,蓄水池大小较高,CD8免疫衰老细胞百分比较高,TREC较低,VCAM细胞因子较高,CD4 PD-1 %较高。Cluster2中间。患者与cluster1类似,但t-bet表达水平较低,HIV DNA库大小较高。
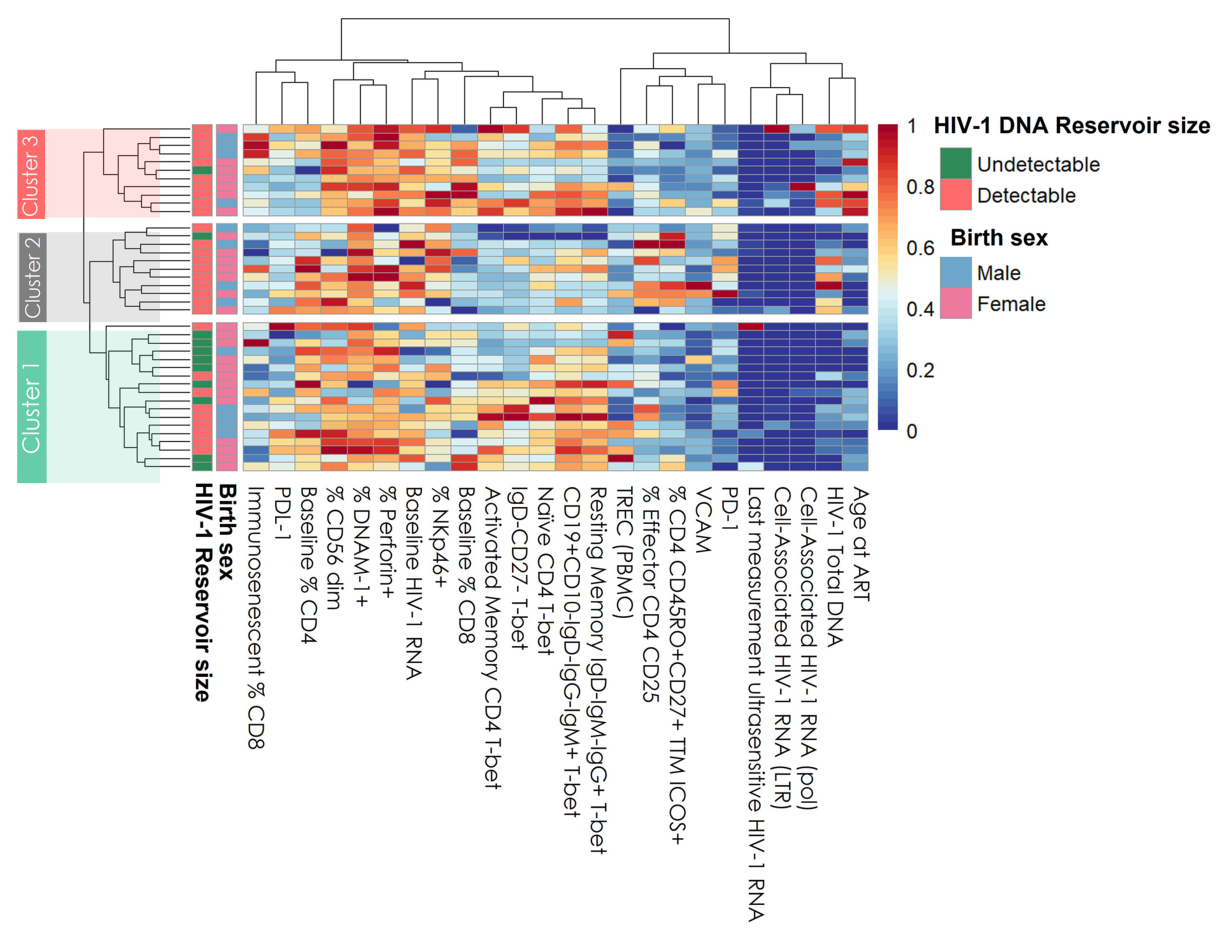
图1 |基于临床、免疫和病毒学特征的所有患者的分级聚类。热图上的列代表患者特征。行是研究中的每个受试者(n = 40)。标绘标准化值:红色表示较高的值;蓝色表示较低的值。抗逆转录病毒疗法;VL,病毒载量;TREC,T细胞受体切除环;检测不到,≤10拷贝/mL;可检测的> 10个拷贝/毫升。
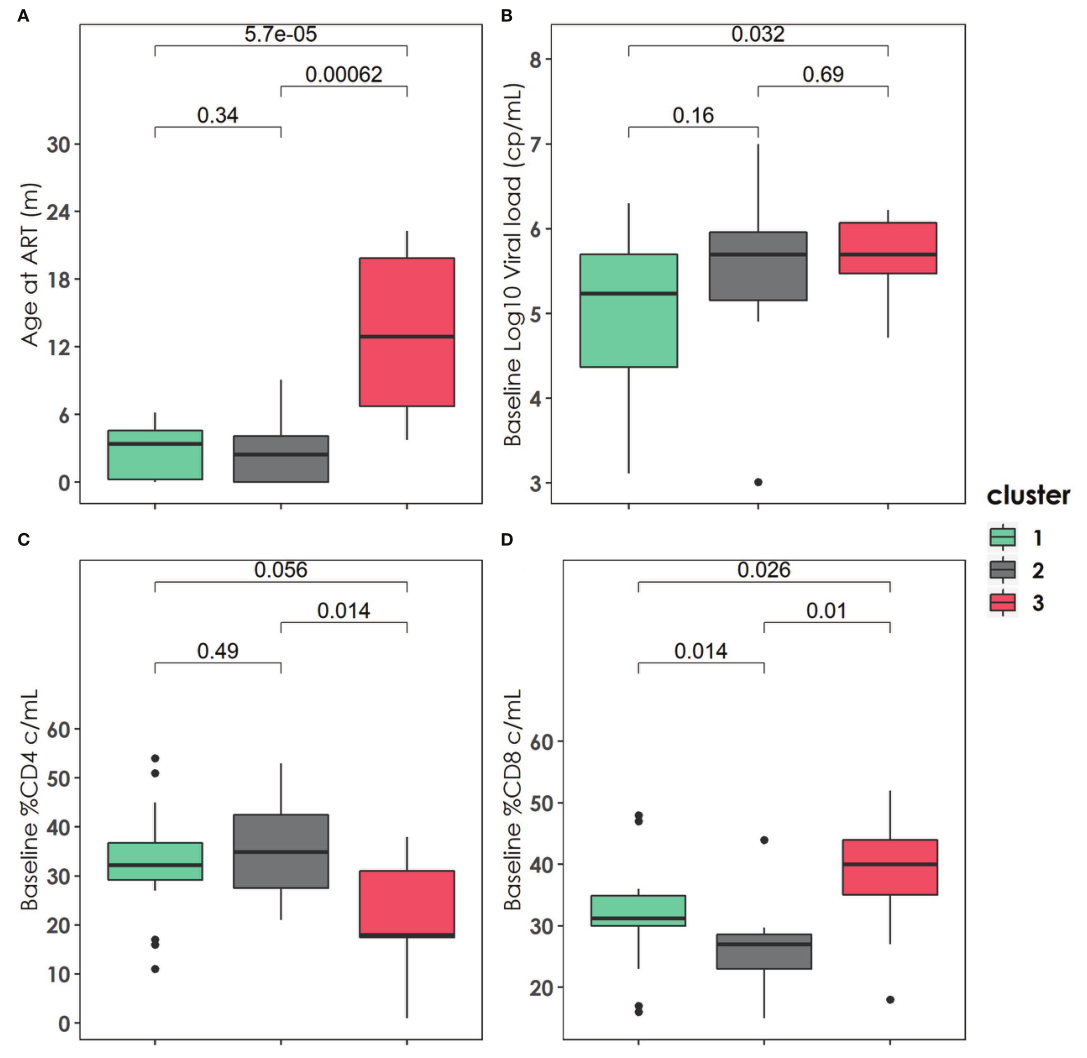
图2 |所描述的三个集群的基线临床、免疫和病毒学特征。(A)接受抗逆转录病毒治疗的年龄在三个组群中的分布。(B)三个集群中的基线Log10病毒载量(拷贝数/毫升)分布。(C)三个集群中的基线% CD4(细胞/毫升)分布。(D)三个集群中的基线%CD8(细胞/毫升)分布。适当时使用U-Mann Whitney检验和Kruskal-Wallis检验计算p值。
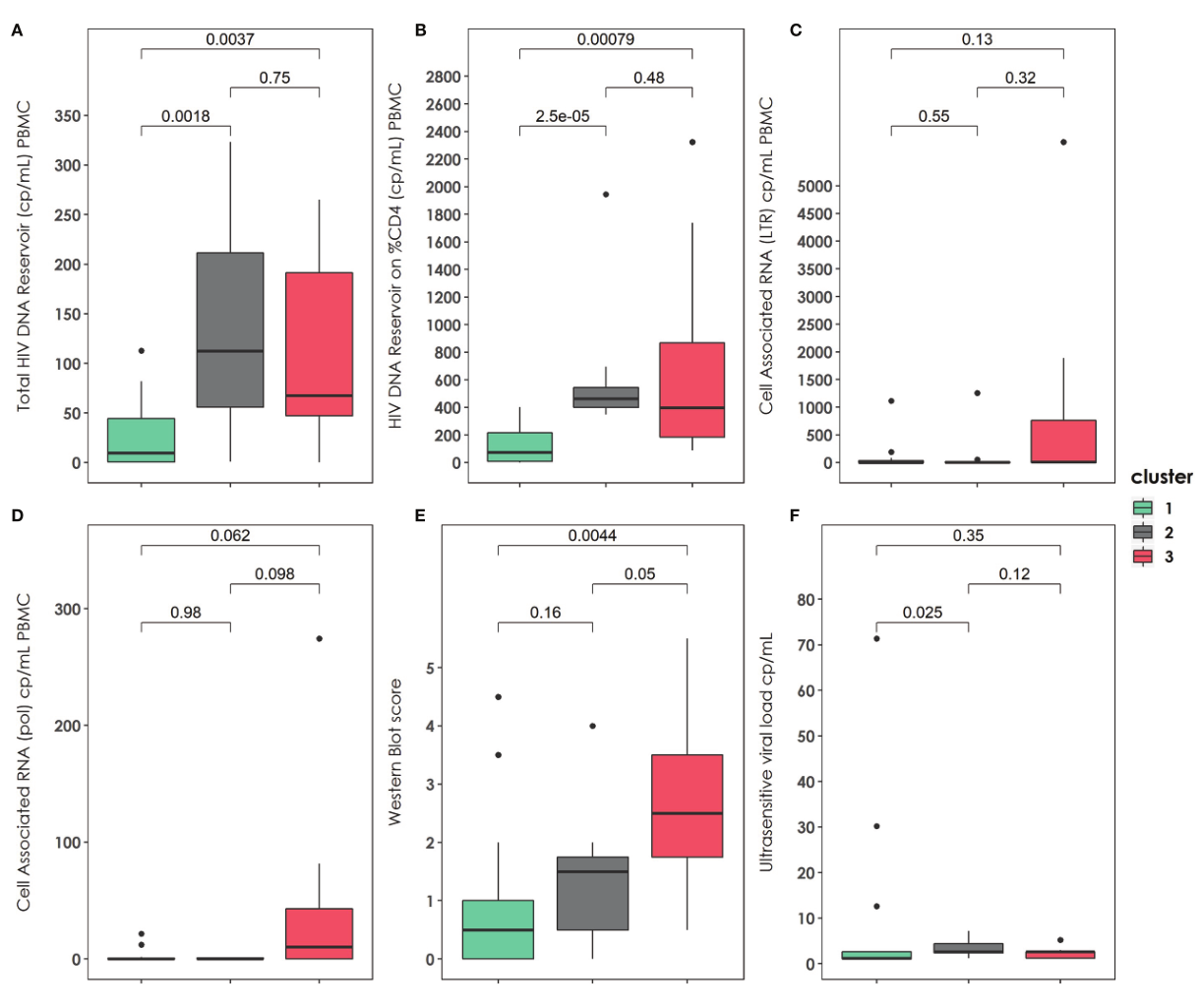
图3 |随访结束时描述的三个集群的病毒学特征和Western-Blot评分。(A)PBMC在群集间分布的总艾滋病毒库大小(拷贝数/毫升)。(B)艾滋病毒DNA库的大小取决于CD4在群集间的百分比分布。(C)簇间LTR区的细胞相关RNA(拷贝数/毫升)分布。(pol区域的细胞相关RNA(簇中的拷贝数/毫升分布)。(E)蛋白质印迹分数在聚类中的分布。(F)超灵敏病毒载量测量在群集间的分布。PBMC:外周血单核细胞。适当时使用U-Mann Whitney检验和Kruskal-Wallis检验计算p值。
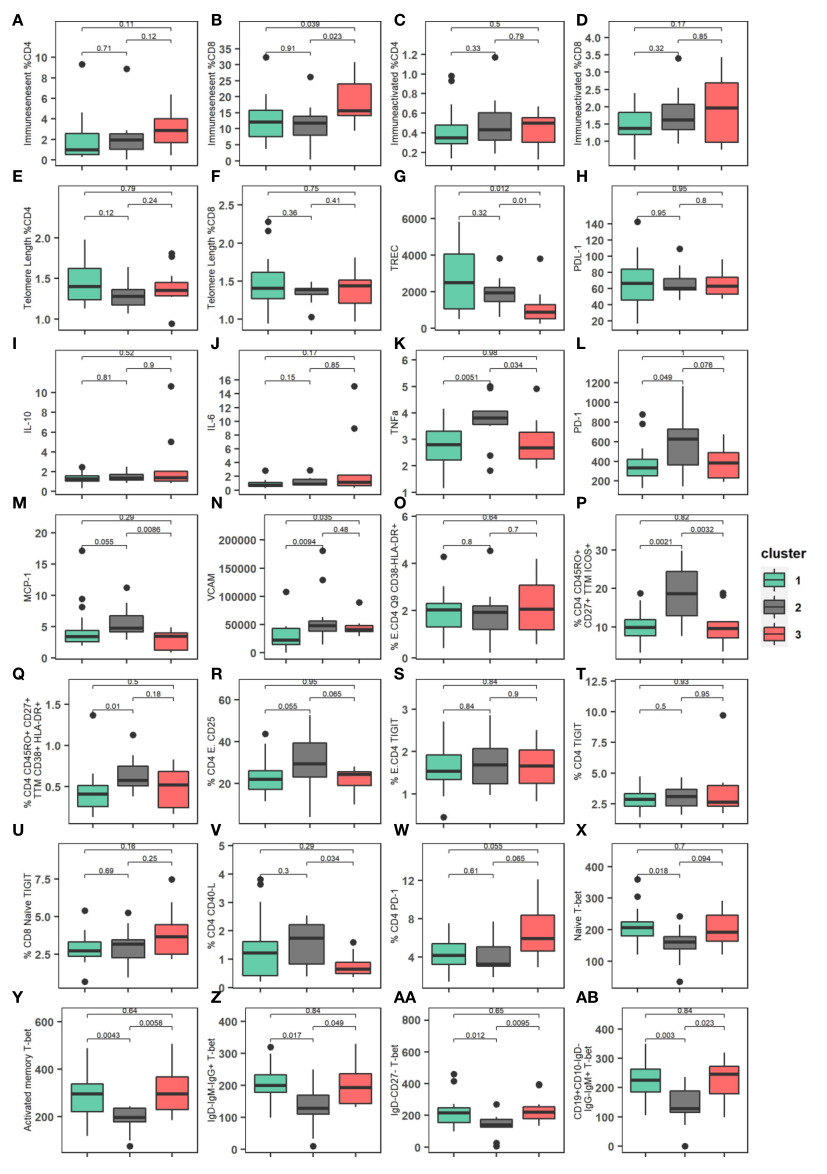
图4 |所描述的三个群集的免疫学特征。(A)免疫生成CD4细胞在集群中的百分比。(B)免疫生成CD8细胞在簇中的百分比。(C)免疫活化的CD4细胞在集群中的百分比。(D)簇中免疫活化的CD8细胞的百分比。(E)簇中CD4细胞百分比的相对端粒长度。(F)簇中CD8细胞百分比的相对端粒相对长度。(G) TREC (T细胞受体重排切除环)水平/簇中的105 PBMC。(H) PDL-1在聚类中的表达。(I)群集之间的IL-10 (pg/mL)表达。(J)群集之间的IL-6 (pg/mL)表达。(K)簇之间的TFN-α(pg/mL)表达。(1)簇之间的PD-1表达。(M)聚类中MCP-1 (pg/mL)的表达。(N)聚类中的VCAM (pg/mL)表达。(O)簇中效应CD4 T细胞表达CD38HLA-DR+的百分比。(P)聚类中CD4表达百分比CD45RO+ CD27+ TTM ICOS+。(Q)CD4 CD 45 ro+CD27+TTM CD38+HLA-DR+在集群中的百分比。(R)簇中效应子CD4 CD25+的百分比。(S)簇中效应子CD4 TIGIT受体的百分比。(T)聚类中CD4 TIGIT受体的百分比。(U)聚类中CD8幼稚TIGIT受体的百分比。(V)CD4 CD40-L在聚类中的百分比。(W)CD4 PD-1在聚类中的百分比。(X)集群中原始CD4 T-bet表达的分布。(Y)激活的记忆CD4 T-bet表达在集群中的分布。(Z)群集中静息记忆IgD- IgM- IgG- T-bet表达的分布。(AA)IgD-CD27-T-bet表达在集群中的分布。(AB)CD19+CD10-IgD-IgG-IgM+T-bet表达在群集间的分布。使用Kruskal-Wallis检验计算p值。
结论:确定了具有不同病毒学和免疫学特征的三种HIV儿科亚型。最有利的群集的特征在于免疫重建的速率较高且疾病进展较慢,而较不利的群集具有更多衰老和较高的储库大小。在不久的将来,不同的亚型可能会引导或支持治疗途径的治疗性干预。
原文出处:Domínguez-RodríguezS,TagarroA,FosterC,et al.Clinical, Virological and Immunological Subphenotypes in a Cohort of Early Treated HIV-Infected Children.Front Immunol2022;13






