感染后产生的新冠病毒抗体,却成了导致重症和死亡的帮凶?
新冠病毒感染后,患者表现出的症状差异很大,从无症状到重症肺炎甚至死亡,病情的严重程度与体内炎症息息相关,剧烈的炎症是导致患者出现呼吸窘迫及全身多器官衰竭的元凶。 尽管在奥密克戎流行期间,重症率和之前的毒株相比,已经大幅下降,但我们至今仍未明白为什么有些人感染新冠病毒后会发展成重症,新冠病毒是如何点燃他们体内的炎症风暴的? 近期,来自波士顿儿童医院的研究团队首次揭开了这一问题的答案,令人意外的是,
新冠病毒感染后,患者表现出的症状差异很大,从无症状到重症肺炎甚至死亡,病情的严重程度与体内炎症息息相关,剧烈的炎症是导致患者出现呼吸窘迫及全身多器官衰竭的元凶。
尽管在奥密克戎流行期间,重症率和之前的毒株相比,已经大幅下降,但我们至今仍未明白为什么有些人感染新冠病毒后会发展成重症,新冠病毒是如何点燃他们体内的炎症风暴的?
近期,来自波士顿儿童医院的研究团队首次揭开了这一问题的答案,令人意外的是,新冠病毒竟然会感染免疫细胞,导致单核细胞和肺部巨噬细胞发生炎性坏死,并且这一过程是靠着新冠抗体在发挥着“牵线搭桥”的作用。该研究以加速预览(Accelerated Article Preview)的形式,于4月6日在Nature官网上线。

研究人员将新冠患者新鲜的血液样本与健康人的血液样本进行分析对比,结果显示:在新冠患者的血液中,大约有6%的单核细胞在经历着焦亡(Pyroptosis),又称为炎性坏死,焦亡的细胞不断胀大,直至细胞膜破裂,释放细胞因子和趋化因子等。
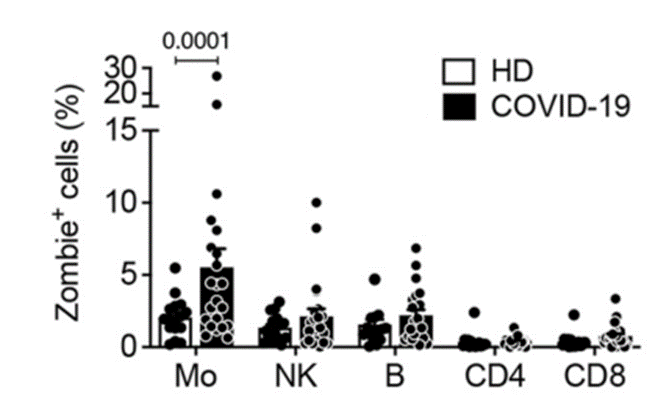
不仅如此,新冠死亡病例的肺部尸检标本中也观察到了有近1/4的肺巨噬细胞出现焦亡,巨噬细胞和单核细胞功能类似,都是作为“前哨细胞”,在病原体入侵时做出反应。
在感染早期,这些焦亡的细胞释放的物质作为“警报”,可以招募其他免疫细胞到感染发生部位,及时清除病原体,然而当焦亡的细胞越来越多时,炎症分子大量释放,炎症反应失控,导致患者出现呼吸窘迫及全身多器官衰竭。
除此以外,研究者还发现,焦亡的细胞越多,患者的症状越重,和轻度及中度症状的新冠患者相比,重症患者血液中焦亡标志物,包括GSDMD, LDH, IL-1RA、 IL-18水平明显上升。
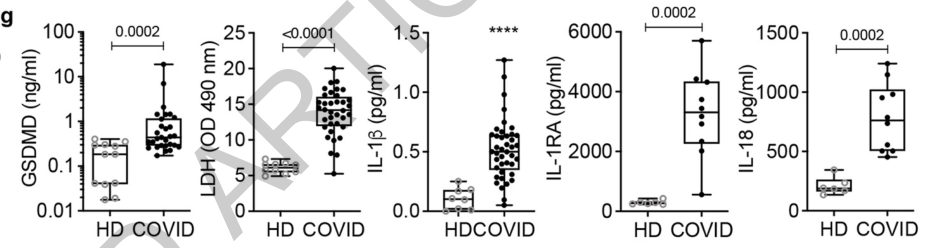
那么是什么原因导致新冠患者体内的单核/巨噬细胞出现焦亡呢?
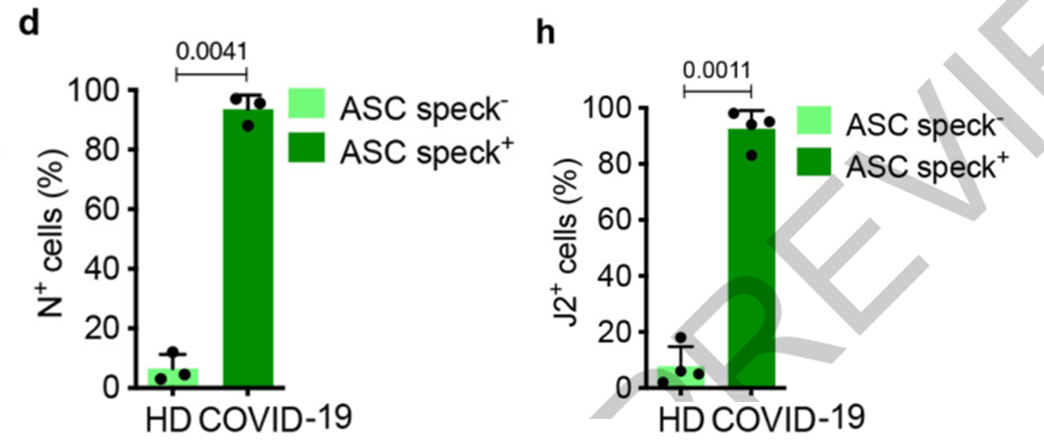
接下来,令人惊讶的事出现了,研究人员在这些焦亡的单核细胞和巨噬细胞中找到了新冠病毒感染的迹象——大约有10%的单核细胞及8%的肺巨噬细胞中存在新冠病毒的核蛋白壳及双链RNA。
说明新冠病毒不仅进入到了细胞内部,还试图进行复制,而这些被感染的单核细胞及巨噬细胞无一例外都发生炎症小体激活,并走向焦亡,说明新冠病毒的直接感染是单核/巨噬细胞焦亡的直接原因!
我们知道,新冠病毒感染细胞靠的就是病毒表面的刺突蛋白与细胞的ACE2受体结合,就像钥匙开锁一样,打开进入细胞的大门。问题是,单核细胞并不表达ACE2,病毒是怎么感染的呢?
有一点十分关键,研究人员在实验中发现,病毒更偏向感染那些携带CD16(FcγRIIIa)的单核细胞,一半左右的CD16+的单核细胞被感染了新冠病毒,而CD16-的单核细胞则几乎不被感染。
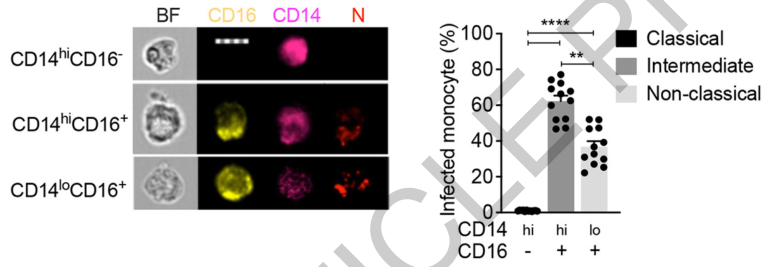
由于CD16能够与抗体的Fc段结合,进而吞噬那些与抗体相连的病原体,据此,研究人员推测,新冠病毒与体内产生的新冠抗体结合之后,抗体末端的Fc段又被单核细胞表面的CD16捕获,单核细胞的细胞膜内陷,将抗体和病毒一并吞入细胞内,造成感染。
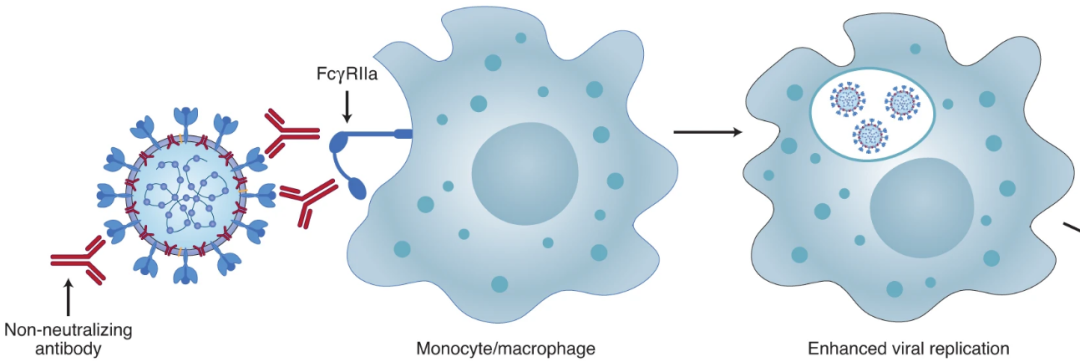
图注:新冠病毒感染单核/巨噬细胞示意图
图源:Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies,原图是描述登革热病毒及FIPV 抗体依赖性的感染增强效应,此处为化用。
为了证明新冠病毒确实是通过新冠抗体和CD16的“牵线搭桥”进入单核细胞,研究人员在体外条件下,将单核细胞与具有感染性的工程病毒株(icSARS-CoV-2-mNG)共培养。
结果发现,正常情况下新冠病毒并不会进入单核细胞,只有在添加了内毒素LPS刺激、新冠抗体或新冠病人血浆的情况下,单核细胞才会被新冠病毒感染。
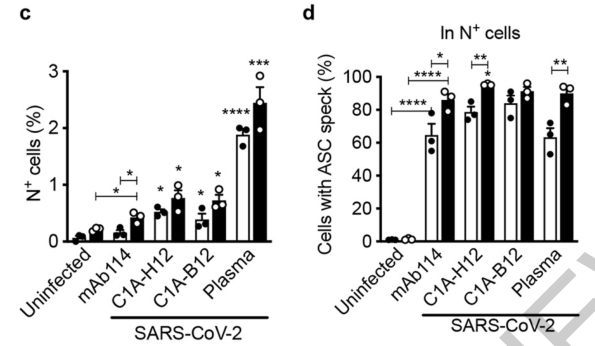
反之,如果去除了新冠病人血浆中的抗体成分,再添加到共培养体系中,单核细胞感染新冠病毒的数量将大幅下降。不仅如此,在培养体系中加入CD16的拮抗剂以此阻断抗体和CD16结合,也能得到类似的效果。说明新冠抗体和CD16在新冠病毒感染单核细胞的过程中缺一不可。
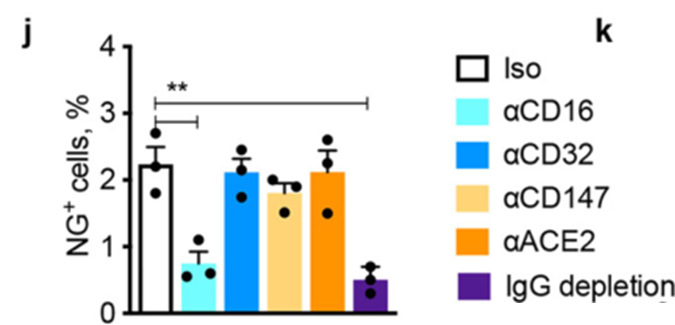
也就是说,新冠抗体不仅不能起到保护作用,反而会促进新冠病毒感染单核细胞和肺巨噬细胞,引起这些细胞发生焦亡,兴起炎症风暴,这令人联想到抗体依赖的感染增强效应(Antibody-dependent enhancement,简称 ADE 效应)。
ADE效应是指人体通过感染、免疫接种或被动输入等方式使机体对某种病原体产生抗体后,这些抗体协助病毒进入靶细胞,提高感染率,引起病情加重的现象。
问题来了,打疫苗后产生的新冠抗体是否也有ADE效应呢?
研究人员将接种过mRNA疫苗、并产生新冠抗体的健康人血浆添加到单核细胞与病毒的共培养体系中,接种疫苗的健康人血浆中的抗体浓度是新冠感染患者的2倍左右(6.5±1.1 μg/ml vs. 3.6±0.5 μg/ml),即使在这种情况下,病毒的感染能力也并没有增强,说明mRNA疫苗产生的新冠抗体并不具有ADE效应。
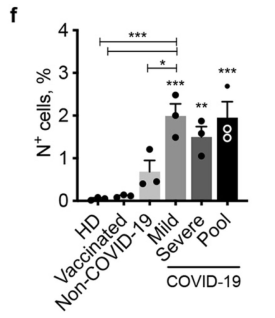
那为什么多数人感染新冠后,体内的抗体产生保护作用,而有的人却发展成了重症?
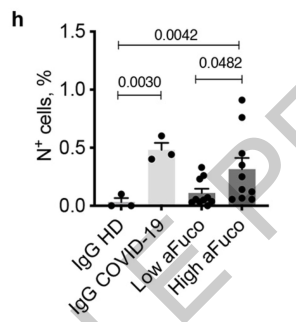
以往的研究显示抗体Fc段的非岩藻糖修饰(afucosylated)会促进抗体与CD16的结合,在共培养体系中加入高浓度(~30%)的非岩藻糖修饰的新冠抗体血浆,和低浓度的非岩藻糖修饰抗体血浆(~8%)相比,明显增强了病毒感染细胞的能力,提示新冠抗体Fc段发生的非岩藻糖修饰很可能是ADE效应产生的原因,关于这一点还需要更进一步研究。
这研究首次在人体中发现新冠抗体存在ADE效应,并且很有可能是导致患者重症及死亡的主要原因。这些抗体促进新冠病毒感染免疫细胞,促使细胞焦亡,引发强烈炎症,加重病情。
从这一角度来说,利用新冠患者血液中的焦亡标志物或能预测疾病进展,或者可以通过抑制细胞焦亡途径来阻止病情进展成为重症。目前已有两款GSDMD抑制剂——Antabuse和Tecfidera进入到新冠治疗临床评估阶段(NCT04485130, NCT04594343, NCT04381936),期待它们能带来好的结果。
参考文献
[1]Junqueira C, Crespo Â, Ranjbar S, et al. FcγR-mediated SARS-CoV-2 infection of monocytes activates inflammation [published online ahead of print, 2022 Apr 6].Nature. 2022;10.1038/s41586-022-04702-4. doi:10.1038/s41586-022-04702-4
[2]Lee WS, Wheatley AK, Kent SJ, DeKosky BJ. Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies. Nat Microbiol. 2020;5(10):1185-1191. doi:10.1038/s41564-020-00789-5
[3]Liu Y, Soh WT, Kishikawa JI, et al. An infectivity-enhancing site on the SARS-CoV-2 spike protein targeted by antibodies. Cell. 2021;184(13):3452-3466.e18. doi:10.1016/j.cell.2021.05.032


.jpg)



