BMP信号通路缺陷和炎症共同促进系统性红斑狼疮相关肺动脉高压
肺动脉高压 (PAH) 是一组以肺动脉压升高为特征的疾病,最终导致右心室衰竭。PAH 的一个主要原因是结缔组织病,包括系统性硬化症 (SSc)、系统性红斑狼疮 (SLE) 等。在这些疾病中,SLE 是亚洲结缔组织病相关 PAH(CTD-PAH)患者的常见危险因素。SLE-PAH 的机制知之甚少。SLE 是一种多系统自身免疫性疾病,其特征是 B 淋巴细胞异常活化,随后产生针对各种自身抗原的自身抗体
肺动脉高压(PAH) 是一组以肺动脉压升高为特征的疾病,最终导致右心室衰竭。PAH 的一个主要原因是结缔组织病,包括系统性硬化症 (SSc)、系统性红斑狼疮 (SLE) 等。在这些疾病中,SLE 是亚洲结缔组织病相关 PAH(CTD-PAH)患者的常见危险因素。SLE-PAH 的机制知之甚少。SLE 是一种多系统自身免疫性疾病,其特征是 B 淋巴细胞异常活化,随后产生针对各种自身抗原的自身抗体 (auto-Abs),导致广泛的临床表现。 功能失调的死细胞碎片清除失去控制,导致先天免疫系统以正反馈方式激活。SLE 的发病机制涉及多种功能失调的细胞死亡方式。Pyroptosis 是一种不同于细胞凋亡的程序性细胞死亡过程,在宿主防御细胞内细菌中起作用,并且还参与自身炎症性疾病。在细胞焦亡的非经典途径中,LPS 被释放到细胞质中并与人类的 Caspase-4 和 -5 以及小鼠的 Caspase-11 结合。这些半胱天冬酶切割 GSDMD,其 N 端启动细胞焦亡,随后激活包含 3 个(NLRP3)炎性体的 NLR 家族 pyrin 结构域(Caspase-1 激活)以切割促炎细胞因子 IL-1β,导致裂解性死亡在细胞中引起肿胀。这些机制是否有助于 SLE 环境中 PAH 的病理生理学尚不清楚。
家族性肺动脉高压 (FPAH) 的遗传研究证实,该疾病是由骨形态发生蛋白受体 2 型 (BMPR2) 基因突变引起的。70% 的遗传性 PAH 患者和 10%–40% 的特发性 PAH (IPAH) 患者携带 BMPR2 突变,但只有 20%–30% 的携带者出现临床表现,表明外显率降低。最近,TGF-β 通路的其他成员,包括激活素受体样激酶 1 型 (ALK1)、内皮糖蛋白和 SMAD9,也与 PAH 相关。
骨形态发生蛋白 (BMP) 属于 TGFβ 信号分子超家族的成员。BMP 是分泌的配体蛋白,可调节范围广泛的发育过程。从功能上讲,BMP 需要一个 1 型受体和一个 2 型受体来发出信号。例如,BMPR2 与 1 型受体的相互作用导致其激酶结构域中的 I 型受体磷酸化。激活的 I 型受体磷酸化受体 Smads (R-Smad1/5/8),后者与称为 Smad4 的核伴侣结合。Smad4 然后易位到细胞核以启动靶基因的转录,例如 ID1。BMPR2 突变(例如在 PAH 患者中检测到的突变)会导致 BMPR2 信号传导不足。已经表明补充 BMP9 或 BMPR2 过表达可抑制 LPS 诱导的中性粒细胞-内皮粘附。
在这里,我们质疑 BMP 受体相关因素,例如针对 II 型或 I 型受体的特异性自身抗体,是否可能参与 SLE-PAH 的发病机制。 为此,我们测量了 SLE-PAH 患者与 SLE 患者和对照受试者的 LPS 和针对 BMP 受体的自身抗体的血清水平。 此外,我们通过类固醇治疗监测了 SLE-PAH 中免疫细胞组成的变化。为了分析细胞焦亡和 BMPR2 信号传导在 SLE-PAH 中的可能参与,我们采用了来自 SLE 相关肺动脉高压 (SLE-PAH) 的患者样本,并建立了类似的小鼠模型,以阐明 BMP 信号在 SLE-PAH 病理生物学中的作用。
患者入组:
2006 年 11 月至 2016 年 3 月在北京协和医院收集了 SLE-PAH(n = 60)和无 PAH(n = 60,年龄和性别匹配)的 SLE 患者的探索性队列。 PAH 的诊断依据是右侧心导管检查 (RHC),静息时平均肺动脉压 (mPAP) ≥ 25 mmHg,肺毛细血管楔压 (PCWP) ≤ 15 mmHg,肺血管阻力 (PVR) > 3 Wood 单位 (WU)。所有 SLE 患者均根据 1997 年美国风湿病学会的标准进行诊断。具有其他重叠 CTD、间质性肺病、肺血栓栓塞、左心功能不全的患者、感染或急性器官功能障碍被排除在外。
研究结果:
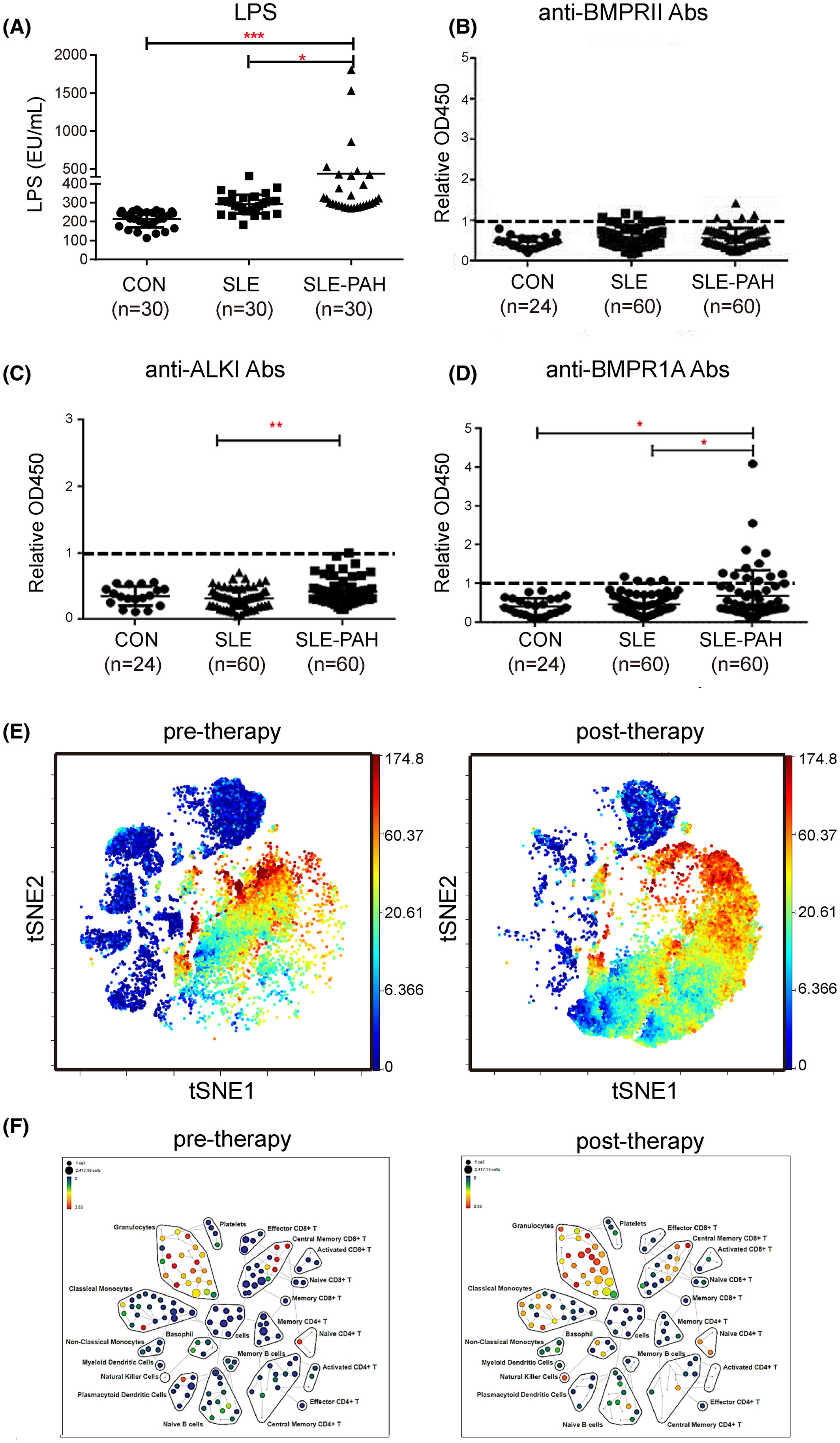
SLE-PAH 患者免疫细胞组成改变的 LPS 和 BMPR 特异性自身抗体水平升高
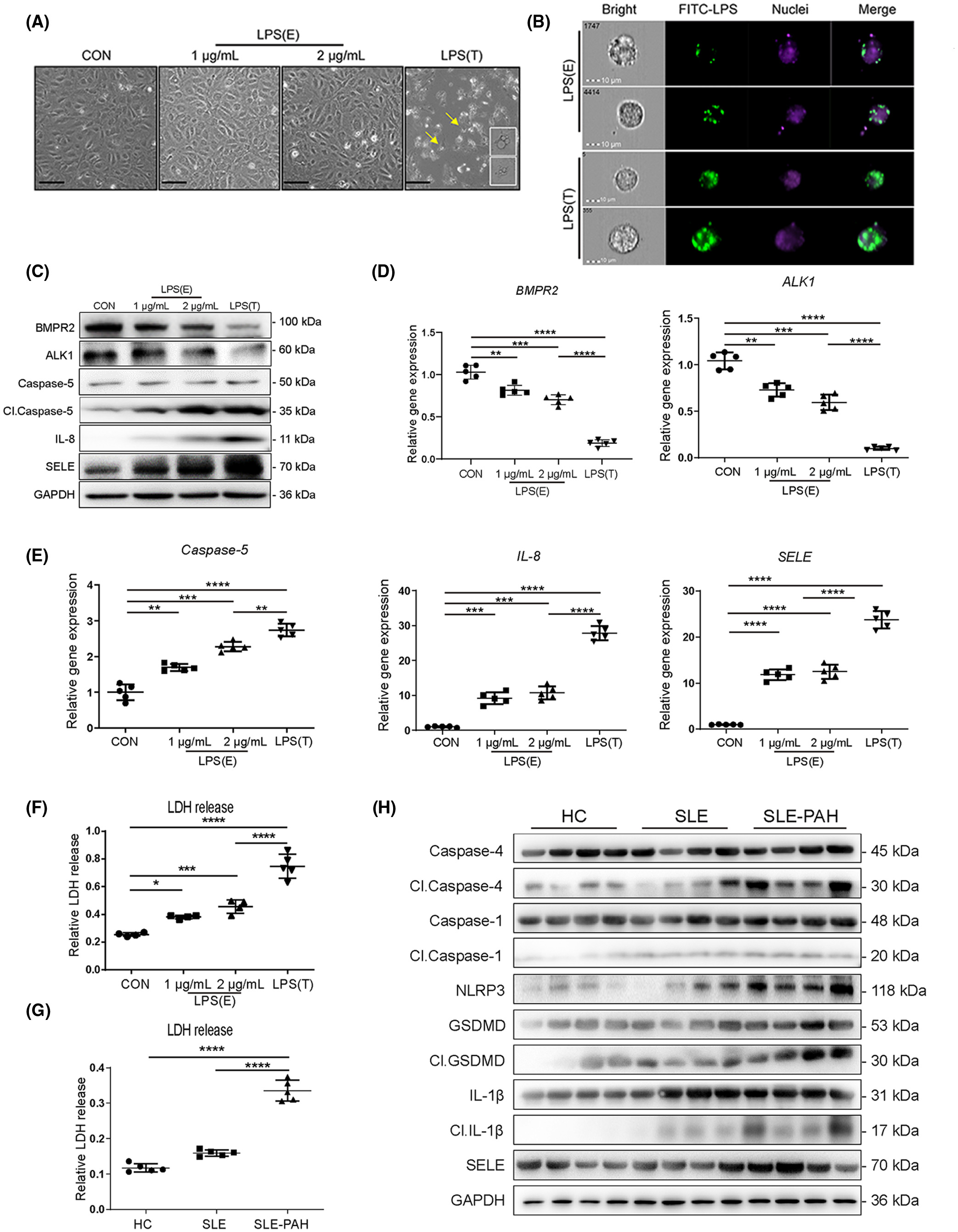
细胞内 LPS 夸大 BMPR2 缺陷以诱导 hPAECs 和 BOECs 的炎症和细胞焦亡
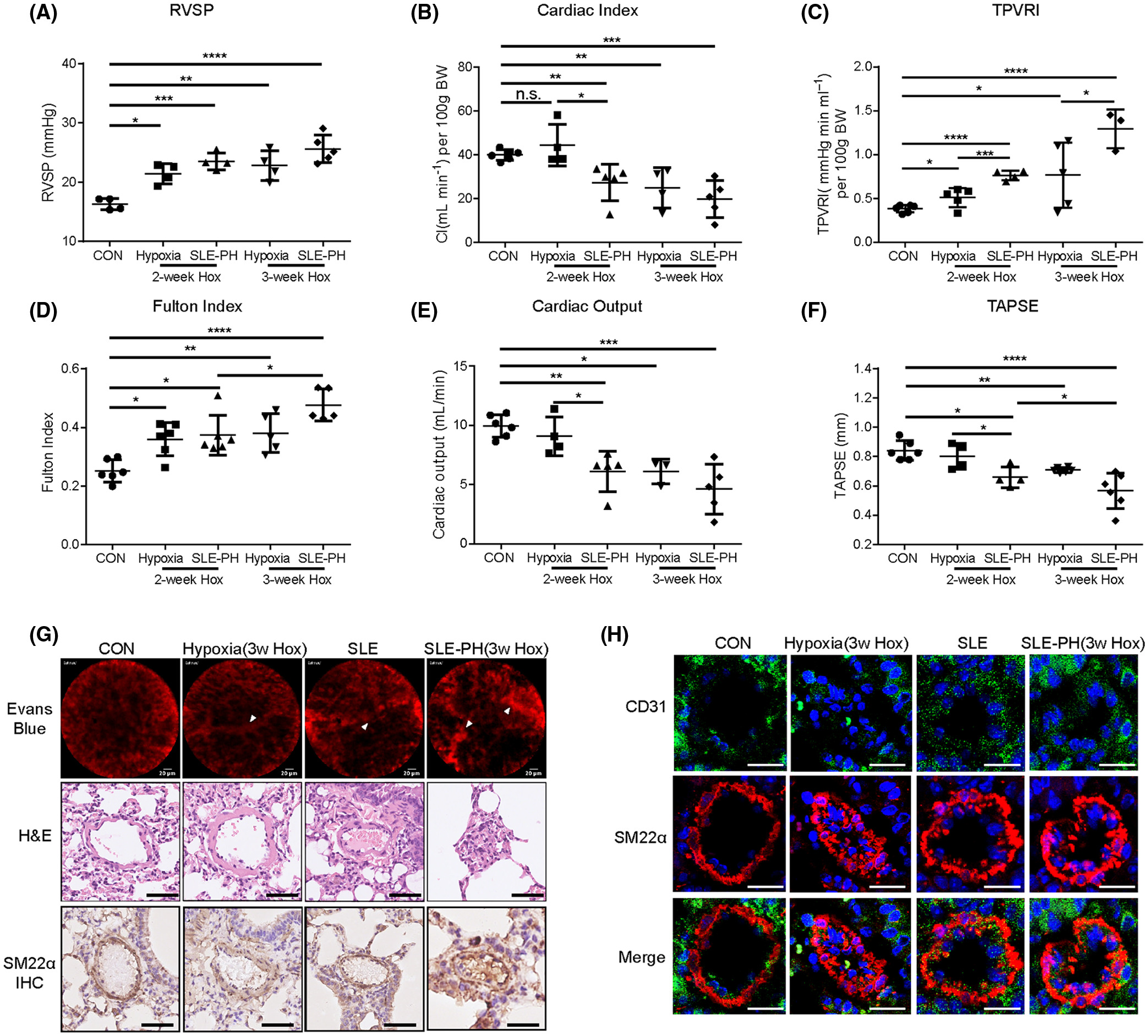
SLE-PAH 患者血清诱导 hPAECs 炎症和细胞焦亡,SLE-PH小鼠自身抗体的产生和肺血管重构
SLE-PH 小鼠的促炎和促焦亡状态
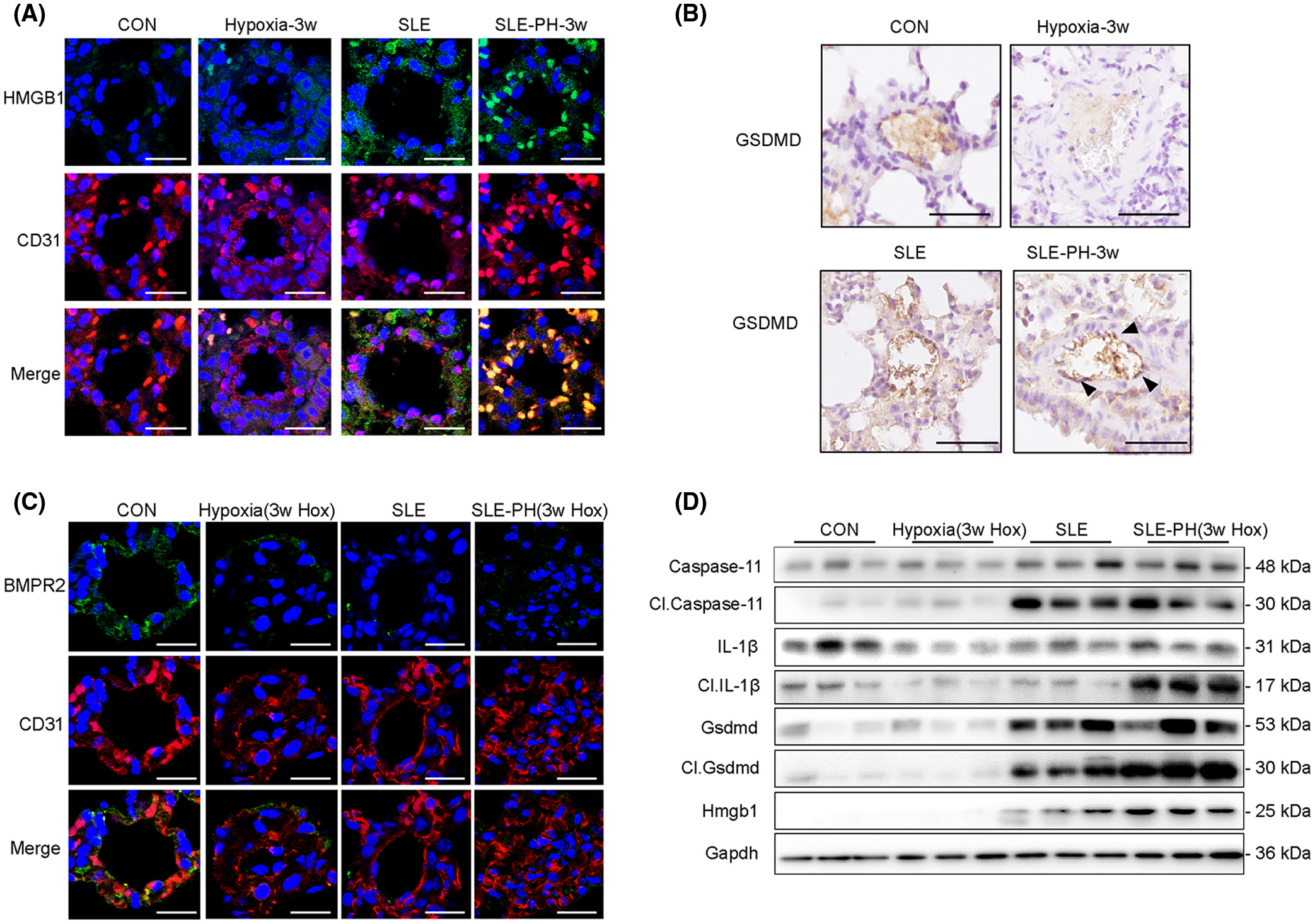
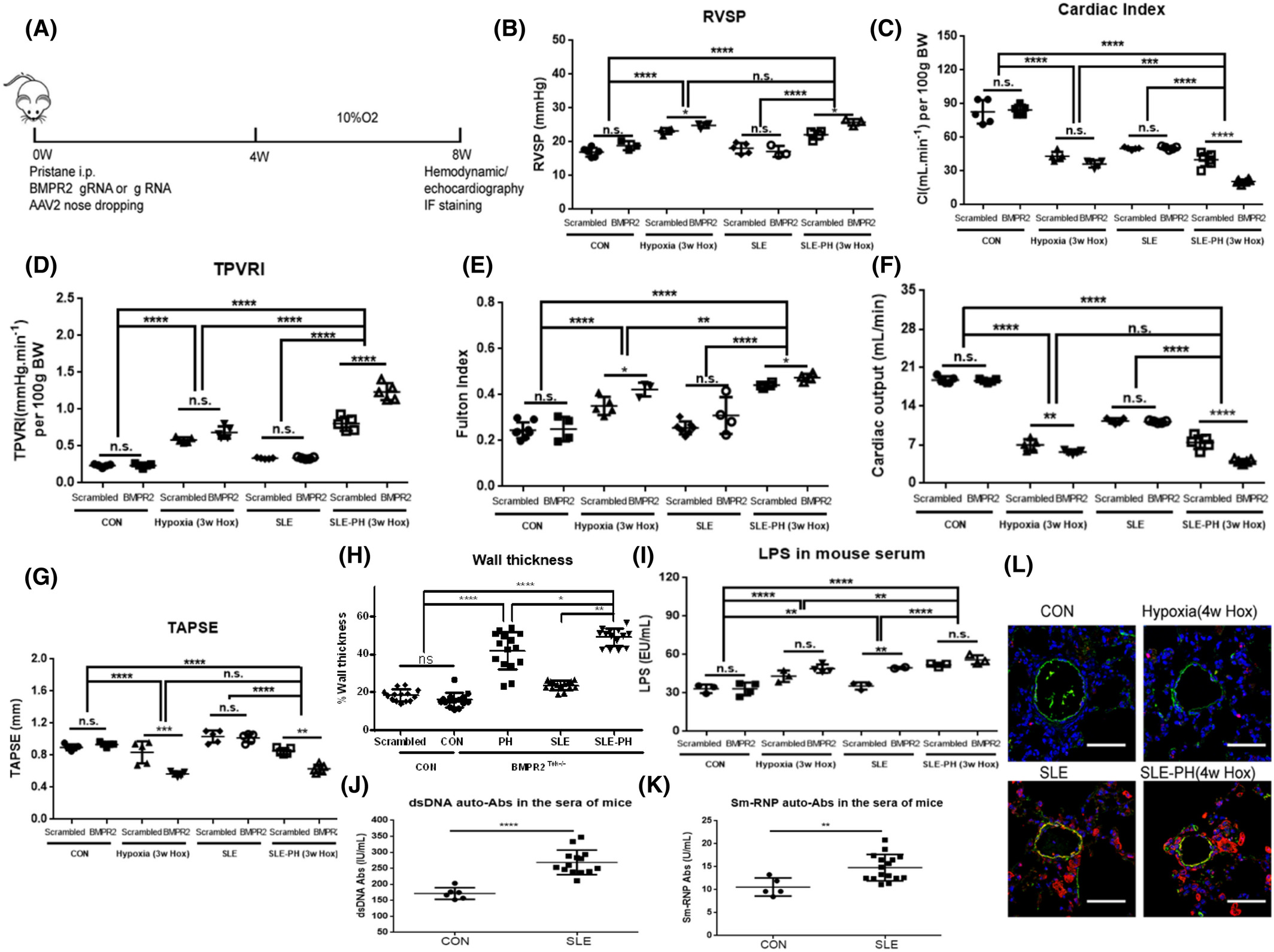
BMPR2缺陷加剧SLE-PH小鼠肺血管重构和细胞焦亡
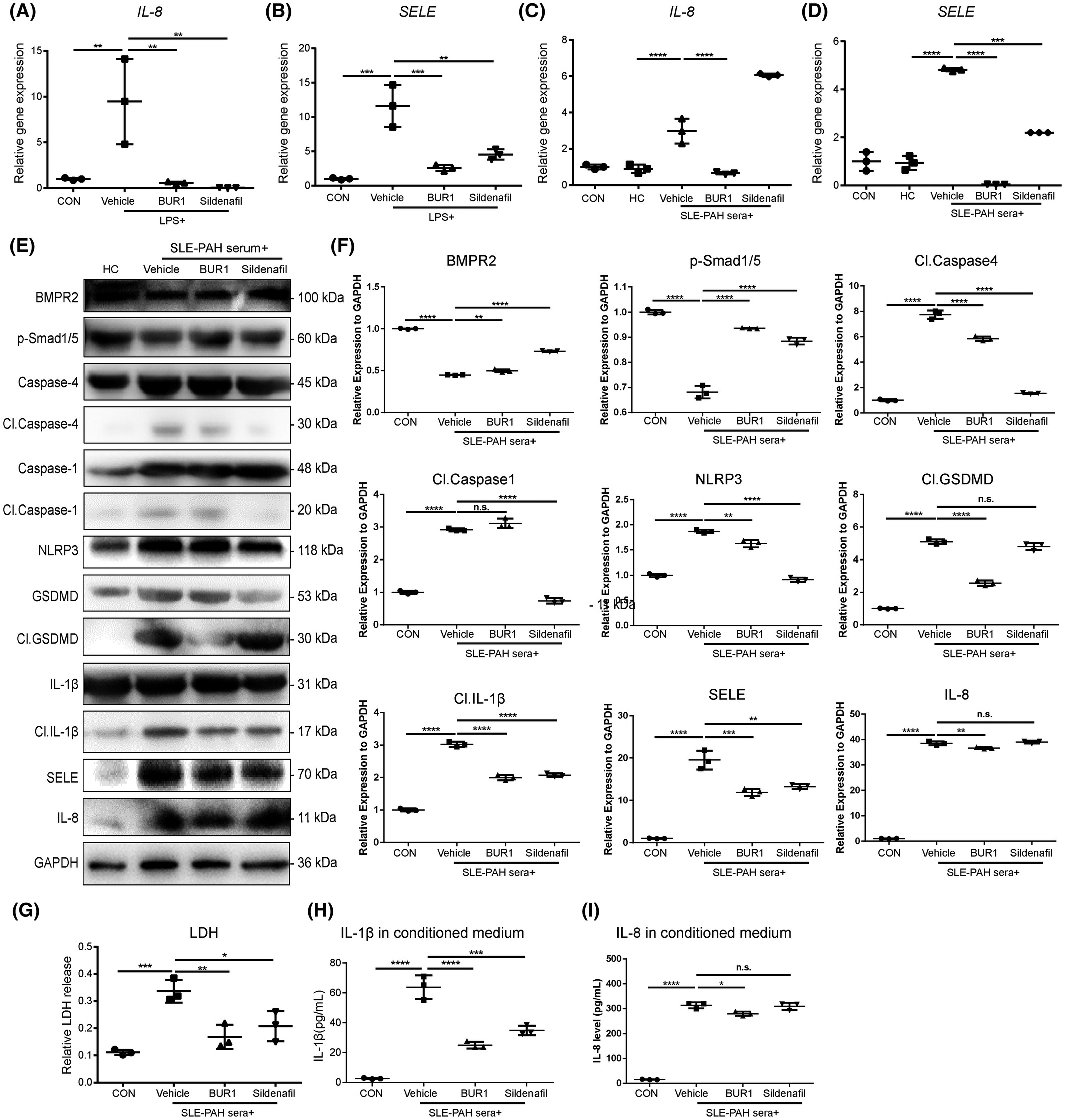
BUR1对SLE-PH小鼠和hPAECs的抗炎作用
研究总结分析:
首先,通过ELISA测量,与对照组相比,SLE-PAH患者血清LPS和针对BMP受体的自身抗体(auto-Abs)水平显着增加。应用质谱流式细胞术比较类固醇治疗前后患者的外周血白细胞表型,结果表明 SLE-PAH 中炎症细胞发生改变。此外,在响应 LPS 刺激的人肺动脉内皮细胞 (PAEC) 中检查了 BMPR2 信号传导和细胞焦亡因子。白细胞介素 8 (IL-8) 和 E-选择素 (SELE) 表达在自体 BMPR2 中上调+/R899X内皮细胞和 siBMPR2 干扰的 PAEC。用降糖素和缺氧诱导的小鼠建立SLE-PH模型。此外,SLE 小鼠中内皮特异性 BMPR2 敲除的组合加剧了肺动脉高压。SLE-PH小鼠肺中包括gasdermin D(GSDMD)在内的细胞焦亡因子升高,并分析了从SLE-PAH患者分离的血清样品对PAECs的焦亡效应。BMPR2 信号上调因子 (BUR1) 在 SLE-PH 小鼠和 PAEC 中显示出抗焦亡作用。我们的结果表明 BMPR2 信号传导和促炎因子的缺陷共同促进了 SLE 中 PAH 的发展。
文章出处:
Xing Y, Zhao J, Zhou M, Jing S, Zhao X, Mao P, Qian J, Huang C, Tian Z, Wang Q, Zeng X, Li M, Yang J. The LPS induced pyroptosis exacerbates BMPR2 signaling deficiency to potentiate SLE-PAH.FASEB J. 2021 Dec;35(12):e22044. doi: 10.1096/fj.202100851RR. PMID: 34818449.






