以色列大规模安全性研究显示BNT162b2疫苗接种是安全的
BNT162b2疫苗是辉瑞公司及BioNTech共同研发的mRNA新冠肺炎疫苗,III期临床试验显示,该疫苗具有较高的新冠肺炎预防效果及可接受的安全性,但受限于临床研究的规模,需要更大规模的研究以评估BNT162b2疫苗的安全性。近日研究人员公布了BNT162b2疫苗在以色列大规模接种后针对疫苗潜在不良事件的研究结论。 研究人员使用了来自以色列最大的卫生保健机构数据以评估BNT162b2 mR
BNT162b2疫苗是辉瑞公司及BioNTech共同研发的mRNA新冠肺炎疫苗,III期临床试验显示,该疫苗具有较高的新冠肺炎预防效果及可接受的安全性,但受限于临床研究的规模,需要更大规模的研究以评估BNT162b2疫苗的安全性。近日研究人员公布了BNT162b2疫苗在以色列大规模接种后针对疫苗潜在不良事件的研究结论。

研究人员使用了来自以色列最大的卫生保健机构数据以评估BNT162b2 mRNA疫苗的安全性。通过比较疫苗接种人群与未接种人群,在疫苗接种后42天的潜在不良事件和风险差异得出研究结论,同时也考虑了新冠肺炎感染对不良事件的影响。
接种疫苗组和对照组均包括884,828名参与者。与未接种人群相比,与疫苗接种密切相关的不良事件包括:心肌炎(RR=3.24,每100000参与者事件风险差异为2.7起)、淋巴结疾病(RR=2.43,每100000参与者事件风险差异为78.4起)、阑尾炎(RR=1.40,每100000参与者事件风险差异为5.0起)以及带状疱疹感染(RR=1.43,每100000参与者事件风险差异为15.8起)。SARS-CoV-2感染使得患者心肌炎风险持续增加(RR=18.28,每100000参与者事件风险差异为11.0起),此外与病毒感染相关的不良事件还包括心包炎、心律失常、深静脉血栓、肺栓塞、心肌梗死、颅内出血和血小板减少症。
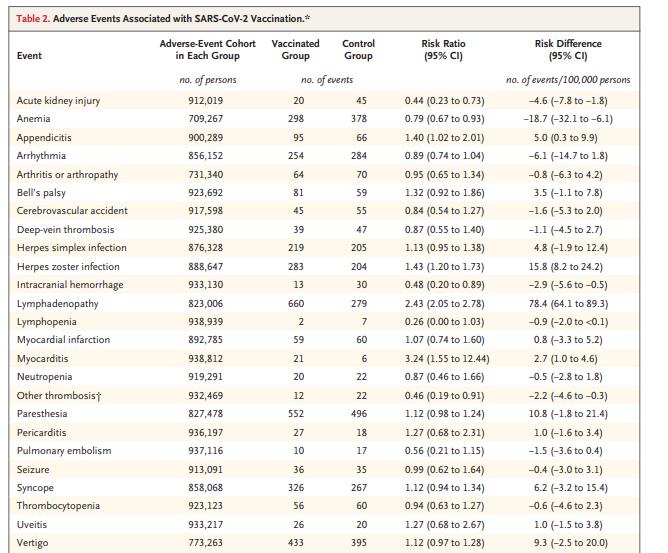
疫苗接种与未接种人群潜在不良事件风险差异
通过以色列卫生系统数据,研究人员认为BNT162b2疫苗与大多数不良事件风险升高无关,有明确证据表明的与BNT162b2疫苗接种相关的严重不良事件仅有心肌炎。
原始出处:
Noam Barda et al.Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting.N Engl J Med,August 25,2021.






