IL-6受体抑制剂Sarilumab用于重症新冠肺炎患者的疗效
促炎细胞因子升高与COVID-19的严重程度增加相关。Sarilumab是一种白介素-6受体抑制剂。本研究旨在评估sarilumab用于重症新冠肺炎(COVID-19)患者的疗效和安全性。 这是在多个国家的45家医院开展的一项为期60天的随机双盲安慰剂为对照的3期试验,纳入18岁及以上的确诊新冠病毒感染的入院治疗的肺炎患者,且要求受试者需要吸氧或重症监护。受试患者随机(2:2:1)分组,分别接受
促炎细胞因子升高与COVID-19的严重程度增加相关。Sarilumab是一种白介素-6受体抑制剂。本研究旨在评估sarilumab用于重症新冠肺炎(COVID-19)患者的疗效和安全性。
这是在多个国家的45家医院开展的一项为期60天的随机双盲安慰剂为对照的3期试验,纳入18岁及以上的确诊新冠病毒感染的入院治疗的肺炎患者,且要求受试者需要吸氧或重症监护。受试患者随机(2:2:1)分组,分别接受静脉sarilumab 400 mg、sarilumab 200 mg或安慰剂。主要终点是达到临床改善2分及以上的时间(7分量表:从1[死亡]到7[出院])。
2020年3月28日-7月3日,共筛查了431位患者,其中420位被随机分组,416位接受了研究治疗:sarilumab 400 mg组 173人(42%)、sarilumab 200 mg组 159人(38%)、安慰剂组 84人(38%)。
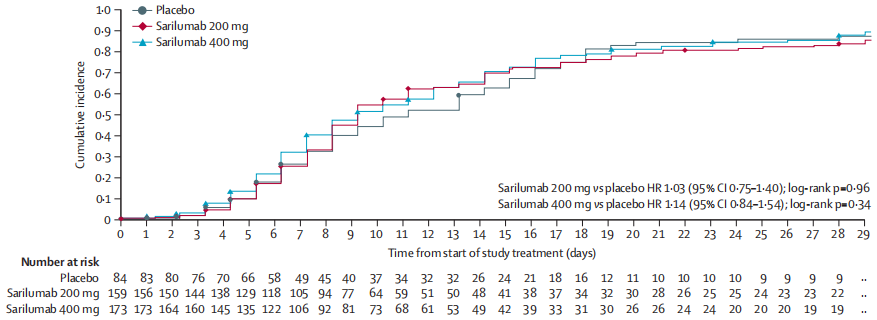
主要终点
第29天时,与安慰剂组相比,sarilumab 200 mg组和sarilumab 400 mg组达改善2点及以上的中位时间无显著差异(12.0 vs 10.0 vs 10.0天);三组的患者存活率也没有显著差别(安慰剂组 vs 200 mg组 vs 400 mg组=92% vs 90% vs 92%)。第29天是,对于重症患者,sarilumab 400 mg组和安慰剂组之间的存活率也无统计学意义的差异(88% vs 79%,p=0.25)。
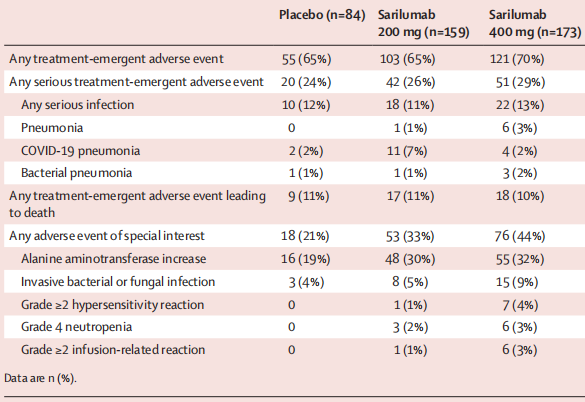
不良反应
未观察到预期之外的安全性问题。安慰剂组、sarilumab 200 mg组和sarilumab 400 mg组需紧急治疗的不良事件的发生率分别为65%、65%和70%,其中三组分别发生了9例(11%)、17例(11%)和18例(10%)不良反应导致的死亡。
三组7分量表评分患者比例变化
综上,该试验未发现sarilumab用于需吸氧的新冠肺炎住院患者具有临床疗效。
原始出处:
Hitoshi Honda, et al.Sarilumab in patients admitted to hospital with severe or critical COVID-19: a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Respiratory Medicine. March 04, 2021.