迷惑新冠病毒,西湖大学/复旦大学合作设计出新冠蛋白抑制剂
肆虐全球的新冠疫情是对全人类共同的考验。疫情发生以来,科学家们一直致力于了解病毒入侵机理,研究破解之道。疫苗以及抗体作为预防和治疗新冠肺炎的重要手段,目前已经取得很大进展。除了这些手段之外,是否还有其他方法能有效遏制新冠病毒? 近日,西湖大学党波波团队、周强团队与复旦大学基础医学院陆路团队在 Cell Research 杂志上联合发表了题为:Engineered trimeric ACE2 bi
肆虐全球的新冠疫情是对全人类共同的考验。疫情发生以来,科学家们一直致力于了解病毒入侵机理,研究破解之道。疫苗以及抗体作为预防和治疗新冠肺炎的重要手段,目前已经取得很大进展。除了这些手段之外,是否还有其他方法能有效遏制新冠病毒?
近日,西湖大学党波波团队、周强团队与复旦大学基础医学院陆路团队在 Cell Research 杂志上联合发表了题为:Engineered trimeric ACE2 binds viral spike protein and locks it in “Three-up” conformation to potently inhibit SARS-CoV-2 infection 的研究论文。
研究团队基于对新冠病毒受体ACE2的设计与改造,构建了多种ACE2三聚体蛋白,其中T-ACE2与新冠病毒刺突蛋白亲和力达到KD<1 pM,同时极大提高了病毒抑制活性。也就是说,研究团队制造了一个ACE2假体蛋白“迷惑”病毒,并且它对病毒的“吸引力”比ACE2本身要高1000倍以上。
人工设计ACE2假体蛋白“诱惑”病毒
此前研究发现,新型冠状病毒感染人体细胞的关键在于冠状病毒的刺突蛋白与人体ACE2蛋白的结合。准确地说,是刺突蛋白“劫持”了原本控制血压的ACE2,通过与它的结合入侵人体。既然ACE2蛋白是病毒入侵人体的闸门,新冠病毒进入人体后,如果我们有一个ACE2假体蛋白,“迷惑”病毒,是不是就能达到抑制病毒的效果?
基于这个思路,长期从事蛋白质设计改造的党波波博士想到了构建一个人工ACE2假体蛋白去结合病毒,从而达到拒绝病毒进入人体的目的。近期研究表明,新冠病毒刺突蛋白以三聚体形态存在,因此研究人员设想构建一个ACE2三聚体蛋白是不是有可能和刺突蛋白三聚体实现3对3或者至少2对2的结合?
随后,研究人员深入研究了冠状病毒刺突蛋白结构并做了一系列的设计改造尝试,他们得到了一个三聚体蛋白T-ACE2,此T-ACE2蛋白可以与新冠病毒刺突蛋白亲和力达到KD<1 pM,相比原来的ACE2单体,与刺突蛋白亲和力提高了超过1000倍。亲和力高了,病毒就会优先结合T-ACE2,从而失去结合细胞表面ACE2的能力,因此T-ACE2具有了非常强的病毒抑制活性。
虽然刺突蛋白本身以三聚体形式存在,但是在没有受体结合的时候,三聚体中的三个单体结构是不同的,三聚体里最多只有一个单体处于开放结构可与受体结合。T-ACE2和刺突蛋白亲和力的极大提高暗示T-ACE2有可能会诱导刺突蛋白构象的变化。为了进一步揭示T-ACE2与刺突蛋白结合的方式,研究团队解析了T-ACE2与新冠病毒刺突蛋白复合物的电镜结构。结构表明:T-ACE2确实可以诱导新冠刺突蛋白发生显着的结构变化,3个单体蛋白同时处于开放状态并同时结合3个ACE2。
党波波表示,“在一开始设计的时候我们完全不确定ACE2三聚体是否会有效果,但是比较神奇的是,T-ACE2做出来之后,亲和力真的实现了极大提高,而且在结合刺突蛋白的过程中,真的诱导刺突蛋白发生了结构变化,从而可以稳固地结合刺突蛋白。为什么会发生这种变化?目前还不清楚,但这对于理解刺突蛋白与受体蛋白ACE2的相互作用应该有重要的启示。这个没有料想到的T-ACE2诱导刺突蛋白结构变化的现象,也是我觉得这项工作最有意思的地方。”
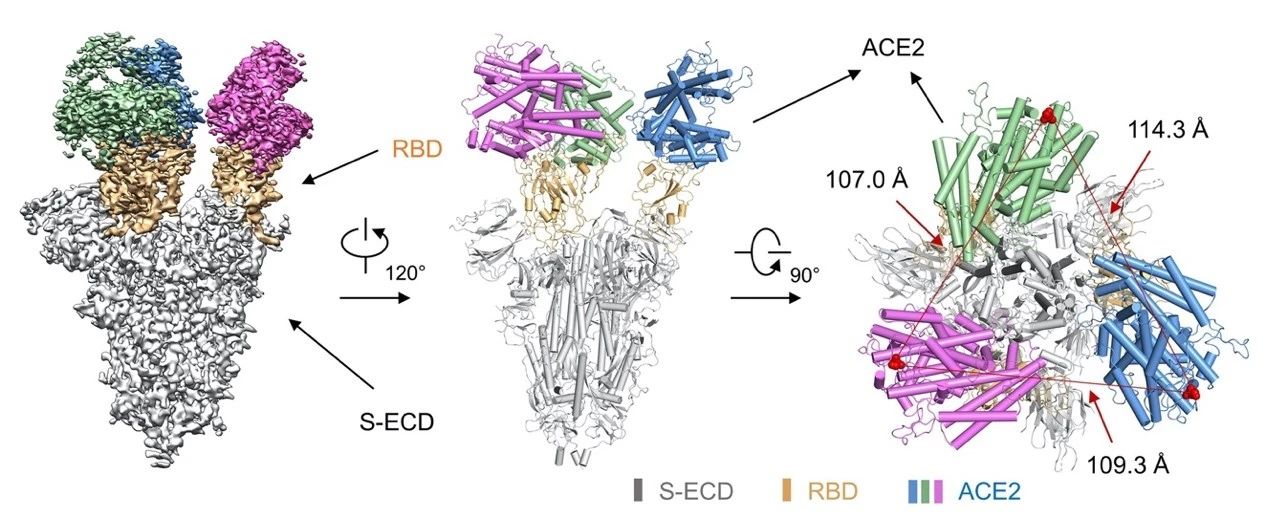
T-ACE2与新冠刺突蛋白复合物的结构
T-ACE2或能适应更多新冠类似病毒
随着疫情发展常态化、病毒变异的积累,已有的蛋白抑制剂(例如抗体)对于新冠病毒及其潜在突变株的作用面临考验。开发能够广谱抑制新冠病毒及其突变株的抑制剂,将成为应对新冠病毒变异及疫情常态化的有效手段。
在ACE2三聚体蛋白设计改造过程中,为了最大程度保留改造后蛋白对于病毒及其突变株的广谱适用性,研究人员选择完全保留天然ACE2的序列(1-615),因为基于天然ACE2序列的改造可以适应多种突变病毒。在本研究中,研究人员也证实T-ACE2对新冠病毒、8种不同天然新冠突变株、非典病毒以及两种新冠类似病毒均有很强的抑制活性,IC50值在0.1nM-3nM范围内。
新冠病毒侵染人体细胞需要通过受体蛋白ACE2实现,因此基于受体蛋白ACE2设计的抑制剂,相比抗体对新冠病毒突变株有着更广谱的抑制能力。此外,此类基于受体ACE2设计改造的蛋白,也将很有可能用于抑制新发或者再现的其他新冠类似病毒。不过T-ACE2作为病毒抑制蛋白的临床应用前景尚待以后更深入的实验验证。
党波波说,T-ACE2因为和病毒刺突蛋白有非常强的亲和力,有望被用于病毒检测方法的开发,也因为T-ACE2是完全基于天然ACE2的序列设计出来的,因此对新冠类似病毒的广谱适用性会比较高,此类基于T-ACE2的检测方法也将能够广泛用于新冠类似病毒检测。
西湖大学特聘研究员党波波、周强,复旦大学陆路为本论文的通讯作者,西湖大学郭梁、毕稳稳、鄢仁鸿、张媛媛,复旦大学王欣玲、徐巍为本论文的共同第一作者。
原始出处:
Liang Guo, Wenwen Bi, Xinling Wang, et al.Engineered trimeric ACE2 binds viral spike protein and locks it in "Three-up" conformation to potently inhibit SARS-CoV-2 infection.Cell Res. 2020 Nov 11;1-3. doi: 10.1038/s41422-020-00438-w.






