指南规范:抗病毒药物在儿童病毒感染性呼吸道疾病中的合理应用指南
是儿童最常见的疾病之一,主要由病毒和细菌感染引起,病毒感染占70%以上[1]。研究表明,有200多种已知病毒可引起呼吸道感染性疾病,有些病毒还具有传播速度快、危害大、病死率高、存在共感染等特点[2-3]。儿童呼吸系统解剖生理特点及尚未成熟的免疫系统决定其易患多种病毒感染性疾病[4-5]。我国2016年5岁以下儿童中,肺炎的病死率为167.2/10万,位列疾病致死人数之首位[6]。一项儿童肺炎病原
是儿童最常见的疾病之一,主要由病毒和细菌感染引起,病毒感染占70%以上[1]。研究表明,有200多种已知病毒可引起呼吸道感染性疾病,有些病毒还具有传播速度快、危害大、病死率高、存在共感染等特点[2-3]。儿童呼吸系统解剖生理特点及尚未成熟的免疫系统决定其易患多种病毒感染性疾病[4-5]。我国2016年5岁以下儿童中,肺炎的病死率为167.2/10万,位列疾病致死人数之首位[6]。一项儿童肺炎病原调查研究结果显示,引起5岁以下儿童重症肺炎的病原中病毒占比为61.4%[7]。近些年,呼吸道病毒流行给全球人民的生命健康带来重大威胁,如2003年的严重急性呼吸综合征(severe acute respiratory syndrome, SARS)和2012年的中东呼吸综合征(middle east respiratory syndrome, MERS),而2009年的新型甲型H1N1流感和2019年底出现的新型冠状病毒肺炎(Corona virus disease 2019, COVID-19)的全球大流行,甚至成为“国际关注的突发公共卫生事件(public health emergency of international concern, PHEIC)”。儿童作为易感人群,如何规范、有效使用抗病毒药物进行防治,是每位儿科医务工作者面临的挑战。 对于病毒感染性疾病,有效抗病毒药物不多,截至2020年4月,我国药品监督管理局(NMPA)数据库中收录的适用于病毒感染性呼吸道疾病的药品及相应品规较少[8],其中可适用于儿童使用的更少,而且存在诸多使用不规范的问题。鉴于病毒感染性呼吸道疾病引起的严重威胁和儿童抗病毒药物临床使用不规范的现状,为解决临床儿童用药的困境,中国医院协会联合国家儿童医学中心、国家感染性疾病医疗质量控制中心、国家呼吸系统疾病临床医学研究中心等学术机构共同拟定《抗病毒药物在儿童病毒感染性呼吸道疾病中的合理应用指南》,旨在为各级儿科医师在儿童病毒感染性呼吸道疾病中的规范使用提供参考。
1
儿童呼吸道感染的常见病毒
引起儿童呼吸系统疾病的常见病毒包括呼吸道合胞病毒(respiratory syncytial virus,RSV)、鼻病毒(human rhinovirus,HRV)、副流感病毒(parainfluenza virus,PIV)、流感病毒(influenza virus,IV)、腺病毒(adenoviruses,ADV)、人偏肺病毒(human metapneumovirus,HMPV)、冠状病毒(coronavirus,CoV)、肠道病毒(enterovirus,EV)等。国内住院急性下呼吸道病毒感染患儿中最常见的为RSV(31.7%)、HRV(23.2%)、PIV(17.2%)、博卡病毒(bocavirus,BoV,11.9%)、ADV(10.4%);门诊患儿中最常见的病毒为IV(11.0%)、ADV(10.9%)、PIV(10.1%)、EV(8.9%)[9-10]。美国一项住院儿童社区获得性肺炎相关研究显示,常见的病毒为RSV(28%),HRV(27%),HMPV(13%),ADV(11%),PIV(7%),IV(7%),CoV(5%)[11]。另外,2019年底发现的新型冠状病毒(2019 novel coronavirus,2019-nCoV)也容易导致儿童呼吸道感染,不可轻视。其中,RSV、HRV、IV、PIV、HMPV、CoV(包括MERS-CoV、SARS-CoV、2019-nCoV等)、EV等为RNA病毒,ADV、BoV为DNA病毒。常见呼吸道病毒及所致疾病类型见表1,伴呼吸系统临床表现的非呼吸道病毒见表2。


2
儿童抗病毒治疗的核心问题及策略与临床用药的基本原则
2.1 儿童抗病毒治疗的核心问题及策略
呼吸道病毒感染多为自限性疾病,大多临床预后良好,但部分患儿在病毒感染后可发展为重症或引起严重的并发症和/或后遗症,严重危害儿童的生命健康。结合我国儿童病毒感染性呼吸道疾病诊疗现状及相关研发进展,总结临床医务工作者在诊疗过程中需要注意的核心问题及策略如下。
(1)早期准确的呼吸道病毒学检查(包括标本采集的规范化)非常重要,应加强儿科呼吸道疾病病毒学实验室检测能力;(2)强调儿科抗病毒药物合理使用与使用安全性的问题。包括充分掌握呼吸道感染性疾病常见病毒的类型及抗病毒药物使用的适应证、禁忌证、不良反应等,必须重视儿科临床中抗病毒药物误用、滥用和重复用药等问题;(3)积极开展和完善儿科抗病毒药物不良反应的监测;(4)鼓励开展儿童抗病毒药物治疗及病毒耐药性监测相关的临床研究,积累循证医学证据;(5)提高对儿科抗病毒药物超说明书用药的认识,建立规范的超说明书用药管理流程;儿科医师应尽量选择可覆盖致病病毒谱的药物和儿童适宜的剂型及品规,避免不必要的超说明书用药。若临床实际确实需要超说明书用药,医师应提供科学的证据,遵循超说明书用药管理流程,并将用药的理由和风险充分告知患儿家属,以降低执业风险。
2.2 基本原则(5R原则)
儿童是一个特殊的群体,在用药种类、剂量与成人有很大区别。儿科医师应在尽量明确病毒感染病原学的前提下,严格掌握抗病毒药物的适应证,根据患儿病情轻重及药物本身理化性质,选用合适的给药途径进行治疗。参考国内外文献及临床实践经验,结合儿童呼吸道感染的病生理特点及抗病毒药物在儿童病毒感染性呼吸道疾病中的使用情况,抗病毒药物的合理使用的基本原则如下。
2.2.1 正确的病人(right patient)
明确的病原学诊断非常重要,但病原学诊断有时并不能及时获得,故流行病学史对诊断亦有重要帮助,而病原学诊断有时并不能及时提供确切依据。临床用药选择过程中诊断的及时性与诊断的准确性有时难以取舍。在某些病毒感染(如流感)的流行季节,及时的药物治疗可能成为主要选择,不能为了明确病原诊断而延误治疗时机。对于某些抗病毒药物疗效不确切的病毒感染,相关诊断在后续治疗中非常重要,药物的选择应当慎重,同时需要注意了解有无合并其他病毒感染和疾病。
2.2.2 正确的药物(right medication)
抗病毒药物包括广谱抗病毒药物、抗RNA病毒药物和抗DNA病毒药物3大类。在病原不完全明确的情况下,及时选择能够覆盖可能病毒的广谱抗病毒药物虽然是推荐的主要选择,但仍要权衡药物使用的利弊。病原明确者应针对性选择相应抗病毒药物。如明确病毒对某种药物有耐药性时可选择其他有效抗病毒药物替代治疗。对严重病毒感染性疾病,应选用作用机制不同、毒性不同的联合用药配合治疗。避免重复或同时使用相同作用机制的2种抗病毒药物。抗病毒药物的使用尽量谨慎遵循相关说明书的年龄限制。
2.2.3 正确的剂量(right dose)
对有确切儿童用药剂量的药物,建议严格在剂量范围内用药,谨慎超量用药,避免小量间歇用药,防止耐药性发生。对没有儿童指导性用药剂量的药物,按体质量或体表面积换算给药或通过成人剂量折算给药时,要密切观察疗效。同时,应根据循证依据及时总结儿童特殊人群,如新生儿人群的用药经验。
2.2.4 正确的时间(right time)
儿童呼吸道病毒感染多为急性,且多具有自限性,但部分患儿仍可发展为重症。为了尽早阻断病情发展,缩短病程,及时减轻患儿症状,抗病毒药物应在明确诊断下尽早使用,但对某些病毒感染,如流感可以不必等待病原诊断结果,而根据临床及流行病学早期使用,对某些病毒感染如巨细胞病毒(CMV)感染在移植患者等特殊人群要给予“抢先”治疗,同时使用疗程需根据不同病毒种类及疾病类型确定,同时应密切关注可能的药物不良反应。
2.2.5 正确的给药途径(right route)
儿童常用抗病毒药物给药途径包括口服、静脉、喷雾和雾化吸入。给药途径的选择应遵循以下原则:局部用药治疗有效者尽量避免全身用药,轻症不必给予不良反应大及静脉注射的抗病毒药物。
在使用抗病毒药物时应根据临床及病原学诊断,严格按照抗病毒药物的适用范围选择用药,同时正确评估抗病毒药物的疗效。从药物安全角度和不良反应方面考虑,在选择抗病毒药物时更应谨慎,并权衡利弊使用,轻症患儿不必给予不良反应大或需静脉注射的抗病毒药物,避免重复使用相同作用机制的抗病毒药物[12]。
3
抗病毒药物及其合理使用
病毒感染后其复制周期分为吸附和穿入、脱壳、生物合成、组装成熟与释放5个步骤,抗病毒药物的作用主要是通过影响病毒复制周期的某个或多个环节而实现的。抗病毒药物按所抑制病毒类型分为广谱抗病毒药物、抗RNA病毒药物和抗DNA药物3类,详见表3。下面选择代表性的抗病毒药物的儿科使用情况进行介绍。
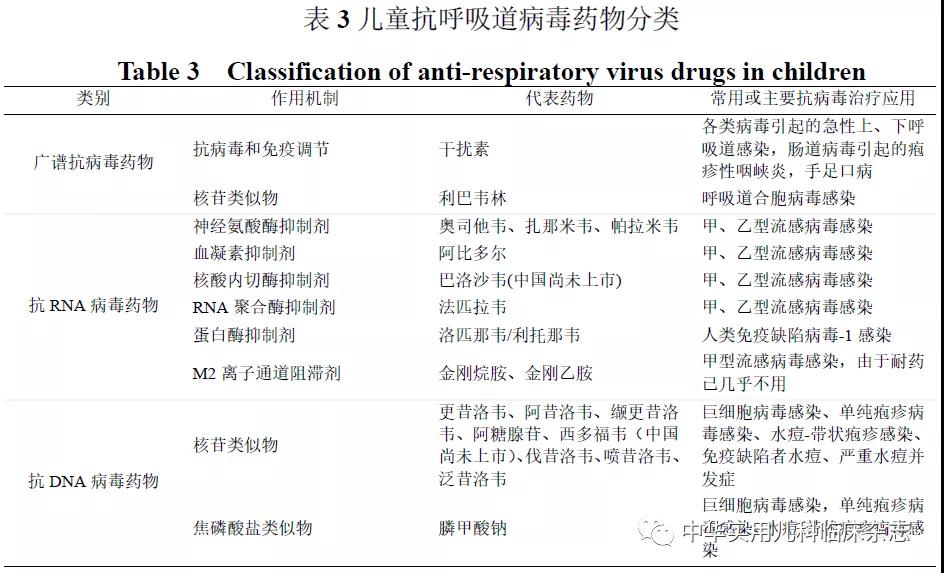
3.1 广谱抗病毒药物 3.1.1 干扰素α(Interferon α, IFNα)
IFN是一类具有广谱抗病毒活性的蛋白质,具有抗病毒和免疫调节的作用[13],分为Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅰ型IFN(主要为IFNα/β)在抑制病毒感染方面发挥重要作用[14]。IFNα诱导细胞产生抗病毒蛋白,降解病毒RNA、抑制病毒RNA和蛋白质的合成,限制病毒复制和扩散,并使正常细胞建立“抗病毒状态”,避免其受到病毒的感染[15]。抗病毒蛋白不特异地针对某一病毒,因而IFNα具有广谱抗病毒活性,对RNA和DNA病毒的复制均有抑制作用,如RSV、PIV、CoV、柯萨奇病毒(CV)、ADV等[16-17]。病毒多在呼吸道黏膜上皮细胞快速增殖,引起呼吸道局部感染或呼吸道以外组织病变,临床常使用IFNα通过喷雾或雾化吸入等方式进行局部治疗,有助于清除病毒,缩短病程,减轻症状,且安全性良好。
IFNα可用于病毒感染引起的儿童急性上、下呼吸道感染,疱疹性咽峡炎和手足口病等[18-23]。此外, IFNα喷雾或雾化也试用于COVID-19的抗病毒治疗[24-28]。推荐用法、用量如下[21,28-31]。
3.1.1.1 IFNα喷雾剂
可用于密切接触病毒感染患者的易感人群或病毒感染早期。(1)急性上呼吸道感染:患儿鼻腔每侧1~2喷、口咽部共8~10喷,每喷含IFNα 0.8万国际单位(IU),每1~2 h给药1次,8~10次/d,80万IU/d,建议疗程5~7 d;接触可疑新型冠状病毒感染患者的高危人群或病毒感染早期表现为上呼吸道症状者用法同上。(2)手足口病、疱疹性咽峡炎:喷于患儿 病变、咽部、双侧扁桃体及皮肤患处,以覆盖整个创面为宜,每1~2 h给药1次,100万IU/d,首日剂量可加倍,建议疗程3~7 d。
3.1.1.2 IFNα雾化吸入
可用于病毒感染导致的儿童急性下呼吸道感染。(1)普通型:IFNα2b每次10万~20万IU/kg或IFNα1b 每次1~2 μg/kg, 2次/d,建议疗程5~7 d。为保证药物有效成分能够抵达小气道和肺部,有效雾化颗粒直径需要达到0.5 μm~10.0 μm(3.0 μm~5.0 μm为佳),雾化装置应使用喷射雾化器(又称射流雾化器、压缩气体雾化器),不应使用超声雾化器和振动筛孔雾化器,后两者会破坏干扰素结构的稳定性[32-34]。(2)重型:每次20万~40万IU/kg或IFNα1b 2~4 μg/kg,2次/d,建议疗程5~7 d。
3.1.1.3 IFNα肌内或皮下注射
在没有雾化条件的医疗机构,毛细支气管炎或病毒性肺炎患儿可酌情选择IFNα肌内或皮下注射。用法用量:IFNα2b 每次10万~20万IU/kg或IFNα1b 每次1~2 μg/kg,1次/d,建议疗程5~7 d。
3.1.1.4 注意事项
IFNα喷雾或雾化治疗一般无明显不良反应,安全性较好。IFNα肌内注射者在初期可出现流感样症状群,长期注射治疗者可能会有骨髓抑制、精神异常等不良反应[29],建议定期复查。肝功能失代偿者、有精神病病史者、有症状的心脏病者及再生障碍性贫血的患儿禁用。目前尚无新生儿及2月龄以下患儿雾化吸入IFNα的临床研究报告,建议慎用。
3.1.2 利巴韦林(Ribavirin)
利巴韦林为合成核苷类广谱抗病毒药,可竞争性抑制病毒合成酶,抑制病毒RNA和蛋白的合成,具有抑制RSV、IV、PIV等多种病毒的作用[35]。静脉或口服给药后主要不良反应为溶血性贫血、血红蛋白减低及贫血、肝功能损害、乏力等。世界卫生组织(WHO)、美国食品及药物监督管理局(FDA)及我国药品监督管理局(原国家食品药品监督管理总局)均曾对利巴韦林的生殖毒性和溶血性贫血等严重不良反应给予了重点安全警示[36],鉴于利巴韦林的不良反应较多且严重,不常规推荐治疗儿童病毒感染性呼吸道疾病。对于重症手足口病患儿,经权衡利弊后可慎重使用,利巴韦林:10~15 mg/(kg·d),分2次静脉滴注,疗程3~5 d,使用过程中要密切关注其不良反应和生殖毒性[31]。
3.2 抗RNA病毒药物 3.2.1 神经氨酸酶抑制剂(neuraminidase inhibitor, NAI)
NAI是治疗流感的有效药物,目前我国批准上市的神经氨酸酶抑制剂有奥司他韦、扎那米韦和帕那米韦。NAI通过抑制IV神经氨酸酶的作用,阻断子代IV从被感染宿主细胞释放而感染新的细胞。IV感染患儿发病48 h内进行抗病毒治疗可减少并发症、降低病死率、缩短住院时间;发病时间超过48 h的重症患儿依然可能会从抗病毒治疗中获益。非重症且无重症流感高危因素的患儿,在发病48 h内,应充分评价风险和获益后再考虑是否给予抗病毒治疗[37]。
有重症流感高危因素的儿童包括:年龄<5岁的儿童(年龄<2岁更易发生严重并发症);伴有以下疾病或状况者:慢性呼吸系统疾病、心血管系统疾病(高血压除外)、肾病、肝病、血液系统疾病、神经系统及神经肌肉疾病、代谢及内分泌系统疾病、恶性肿瘤、免疫功能抑制等。
抗IV药物预防不能代替疫苗接种,只能作为没有接种疫苗或接种疫苗后尚未获得免疫能力的重症流感高危人群的预防措施。对有重症流感高危因素的密切接触者(且未接种疫苗或接种疫苗后尚未获得免疫力)进行暴露后药物预防,建议不要迟于暴露后48 h用药。可使用奥司他韦或扎那米韦,暴露后药物预防剂量同治疗量, 1次/d,使用7 d。
建议6月龄至5岁儿童优先接种流感疫苗[37]。服用NAI预防和治疗期间可以接种流感灭活疫苗或重组流感疫苗。需要注意的是,若儿童计划接种流感减毒活疫苗,需确认其接种前48 h内未服用过NAI,且接种后14 d内也不能服用NAI,否则会降低疫苗的有效性[38]。
3.2.1.1 奥司他韦(Oseltamivir)
奥司他韦是一种乙酯前体NAI药物,用于甲型和乙型流感的治疗和预防,推荐用法用量详见表4~5[37,39-41]。
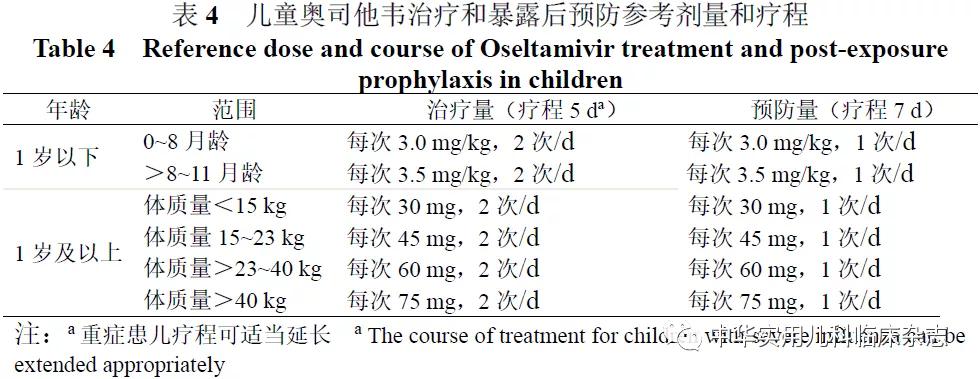
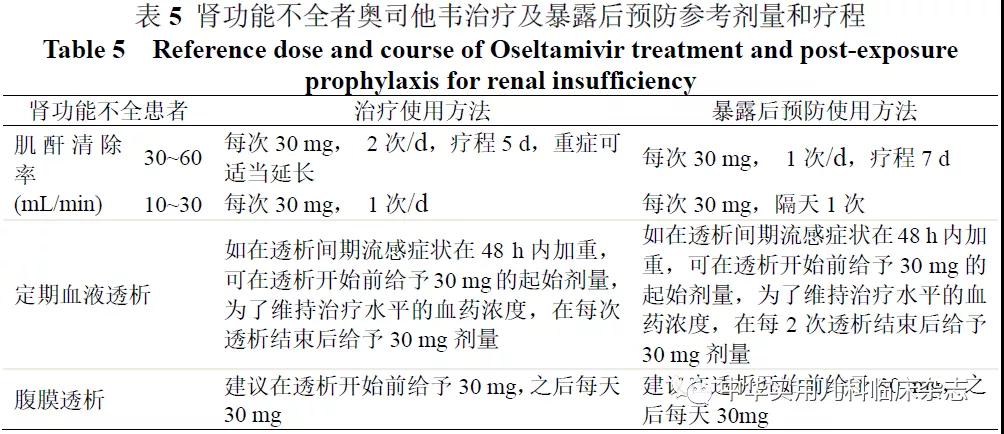
奥司他韦口服耐受性好,无严重不良反应。常见的不良反应为轻度胃肠道反应,大多在用药后2 d内发生,随疗程逐渐减轻或消失,与食物同服可减少胃肠道反应[42]。对于13岁以下儿童的流感暴露后预防、健康状况差或不稳定必须入院的流感患儿、存在免疫抑制的患儿及合并有慢性心脏和/或呼吸道疾病的流感患儿,奥司他韦的安全性和有效性尚不确定。由于早产儿肾功能尚不成熟,药物清除较慢,对足月儿推荐的剂量在早产儿中可能导致药物浓度过高,因此早产儿给药剂量应慎重。不推荐用于肌酐清除率<10 mL/min的患儿和因严重肾衰竭而需定期进行血液透析和/或持续腹膜透析的患儿;轻中度肝功能不全者治疗和预防流感时剂量不需要调整,严重肝功能不全者的药物安全性和药代动力学尚无相关研究。在用药治疗期间,应对患儿的自我伤害和谵妄事件等异常行为进行密切监测[35]。
3.2.1.2 扎那米韦(Zanamivir)
扎那米韦可用于7岁以上青少年甲型和乙型流感的治疗与预防[37],因其口服生物利用度低,仅可通过吸入方式给药。
用法用量推荐[37]:(1)治疗用药:每次10 mg吸入,2次/d(间隔约12 h),疗程5 d,重症患儿疗程可适当延长;(2)预防用药:每次10 mg吸入,1次/d,疗程7 d。
常见不良反应为鼻部症状、头痛、头晕、胃肠道症状、咳嗽、皮疹等。临床工作中需注意:扎那米韦虽为吸入给药,但不能雾化吸入,也不能加入到呼吸机管路中;慢性呼吸系统疾病患儿,特别是哮喘患儿用药后发生支气管痉挛的风险较高,应慎用[41];如在使用本药时需要使用其他吸入药物,如支气管扩张剂等,应先使用其他药物再使用本药。
3.2.1.3 帕拉米韦(Peramivir)
帕拉米韦是我国首个批准经静脉途径给药治疗流感的NAI,用于甲型和乙型流感的治疗,可用于重症流感、无法口服奥司他韦或不能耐受扎那米韦吸入的患儿,不推荐作为流感的预防用药[43-46]。
用法用量推荐[37,44]:<30 d新生儿6 mg/kg,31~90 d婴儿8 mg/kg,91 d~17岁儿童10 mg/kg,静脉滴注,滴注时间30 min以上,1次/d,疗程1~5 d,最大剂量600 mg,重症患者疗程可适当延长。
常见不良反应为临床检测值异常(主要表现为网织红细胞降低、白细胞计数降低、中性粒细胞比降低、淋巴细胞比升高和三酰甘油升高等)和消化系统症状。应谨慎与其他经肾脏消除的药物合用,肾功能障碍者慎用,肌酐清除率为10~30 mL/min的患儿,应调整治疗剂量。
3.2.2 血凝素抑制剂
盐酸阿比多尔(Arbidol)是血凝素抑制剂,通过以下方式发挥抗病毒作用:(1)通过激活体内2, 5-寡聚腺苷酸合成酶,抑制病毒核酸合成;(2)抑制膜融合,阻碍病毒复制;(3)诱导IFN产生,具有免疫调节作用[47]。体外试验证明阿比多尔对个别DNA病毒,如ADV也有一定抑制作用[48]。
俄罗斯[46]使用阿比多尔治疗2岁以上儿童流感,治疗用法用量如下:2~6岁每次50 mg,6~12岁每次100 mg,>13岁每次200 mg,4次/d,疗程5 d;暴露后预防剂量同治疗剂量,1次/d,连续服用10~14 d;流感季预防剂量同治疗剂量,每周2次,连续服用3周。
目前国内尚缺乏阿比多尔治疗儿童流感的大样本、多中心临床研究证实其安全性和有效性,试用时可参考俄罗斯的推荐治疗方案调整单次剂量。在临床应用进一步评价药物疗效,出现不可耐受的不良反应时应停止使用。
我国研究者曾试用阿比多尔治疗COVID-19患者,其有效性仍需进一步临床研究验证[49-51]。其不良反应主要表现为恶心、腹泻、头晕和血清转氨酶增高。
3.2.3 核酸内切酶抑制剂
巴洛沙韦(Baloxavir)主要通过抑制流感病毒帽子依赖的核酸内切酶活性发挥作用[52]。研究显示,巴洛沙韦对流感症状的缓解率与奥司他韦相当,但抑制病毒效果优于奥司他韦。FDA已批准巴洛沙韦可用于治疗12岁及以上患者的急性单纯性流感,我国尚未上市,但现已进入新药快速审评通道。其用法用量如下[53-54]:症状出现的48 h内单次服用,体质量40~80 kg剂量为40 mg;体质量≥80 kg剂量为80 mg。国内试用时可参考美国治疗方案调整单次剂量。
其不良反应与奥司他韦类似,但发生率略低(20.7%)[52],目前<12岁的儿童尚未评估其安全性和有效性,由于其上市时间尚短,需要更多的临床研究进行疗效和安全性评估。
3.2.4 RNA聚合酶抑制剂
法匹拉韦(Favipiravir)是一种前体药,本身没有抗病毒活性,其进入体内后可快速转化为法匹拉韦核苷三磷酸(M6)形式,M6通过模拟鸟苷三磷酸(GTP)竞争性抑制病毒RNA依赖的RNA聚合酶,从而抑制病毒基因组复制和转录来发挥抗病毒作用;M6还可渗入病毒基因,通过诱发致命性的突变发挥抗病毒作用。目前国内获批的适应证为治疗成人新型或复发流感,成人疗程为5 d,第1天,每次1 600mg,2次/d;从第2天至第5天,每次600 mg,2次/d,口服给药[55]。我国有研究者尝试使用法匹拉韦治疗成人COVID-19患者,其疗效和安全性尚需进一步验证[56-58]。其不良反应为血尿酸增加、腹泻、中性粒细胞计数减少等。儿童用法用量尚不明确。不推荐在儿童病毒感染性呼吸道疾病使用。
3.2.5 离子通道M2阻滞剂
离子通道M2阻滞剂主要包括金刚烷胺(Amantadine)和金刚乙胺(Rimantadine),仅对甲型流感病毒(IAV)有效,但目前监测资料显示IAV对其耐药,国内外流感相关指南均不建议使用[37,41,59]。常见不良反应为眩晕、失眠及恶心、呕吐等消化道症状,另外,该类药物的治疗量和中毒量接近,对婴幼儿和老年人的肝肾功能和神经系统损伤较重[60]。我国药品监督管理局为了保护儿童用药安全,曾提出药物安全警示和要求:部分可用于治疗普通感冒的小儿复方制剂及中成药,如氨金黄敏颗粒、小儿氨酚烷胺颗粒及小儿复方氨酚烷胺片等因含有金刚烷胺或金刚乙胺成分,需要按照强制性要求修改说明书,在“禁忌”项中增加了“因缺乏新生儿和1岁以下婴儿安全性和有效性的数据,新生儿和1岁以下婴儿禁用本品”,将“5岁以下儿童应在医师指导下使用”修订为“5岁以下儿童不推荐使用”。因此在临床诊疗过程中需要注意相关复方制剂中有无该药成分[61]。
3.3 抗DNA病毒药物 3.3.1 核苷类似物
核苷类似物是化学合成的抗病毒药物,其化学结构简单,便于修饰和合成。目前我国批准上市的有更昔洛韦(Ganciclovir)、阿昔洛韦(Acyclovir)、缬更昔洛韦(Valganciclovir)、阿糖腺苷(Adenosine Arabinoside)等。
3.3.1.1 更昔洛韦
更昔洛韦进入细胞磷酸化后竞争性抑制DNA多聚酶,并掺入病毒及宿主细胞DNA中,从而抑制DNA的合成[35]。对CMV、单纯疱疹病毒(HSV)-Ⅰ型、HSV-Ⅱ型、水痘-带状疱疹病毒(VZV)具有抑制作用,是目前CMV感染的首选药物[62-63]。
更昔洛韦治疗CMV性肺炎患儿的用法、用量如下:诱导治疗,每次5 mg/kg,每12 h1次,静脉滴注,持续2~3周;维持治疗,每次5 mg/kg,1次/d,连续5~7 d,总疗程约3~4周[62]。
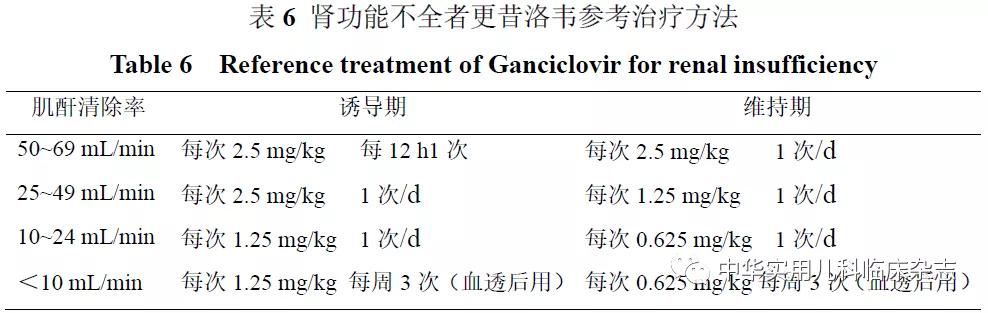
肾功能不全者详参考用量见表6[35]。
3.2.1.2 扎那米韦(Zanamivir)
扎那米韦可用于7岁以上青少年甲型和乙型流感的治疗与预防[37],因其口服生物利用度低,仅可通过吸入方式给药。
用法用量推荐[37]:(1)治疗用药:每次10 mg吸入,2次/d(间隔约12 h),疗程5 d,重症患儿疗程可适当延长;(2)预防用药:每次10 mg吸入,1次/d,疗程7 d。
常见不良反应为鼻部症状、头痛、头晕、胃肠道症状、咳嗽、皮疹等。临床工作中需注意:扎那米韦虽为吸入给药,但不能雾化吸入,也不能加入到呼吸机管路中;慢性呼吸系统疾病患儿,特别是哮喘患儿用药后发生支气管痉挛的风险较高,应慎用[41];如在使用本药时需要使用其他吸入药物,如支气管扩张剂等,应先使用其他药物再使用本药。
3.2.1.3 帕拉米韦(Peramivir)
帕拉米韦是我国首个批准经静脉途径给药治疗流感的NAI,用于甲型和乙型流感的治疗,可用于重症流感、无法口服奥司他韦或不能耐受扎那米韦吸入的患儿,不推荐作为流感的预防用药[43-46]。
用法用量推荐[37,44]:<30 d新生儿6 mg/kg,31~90 d婴儿8 mg/kg,91 d~17岁儿童10 mg/kg,静脉滴注,滴注时间30 min以上,1次/d,疗程1~5 d,最大剂量600 mg,重症患者疗程可适当延长。
常见不良反应为临床检测值异常(主要表现为网织红细胞降低、白细胞计数降低、中性粒细胞比降低、淋巴细胞比升高和三酰甘油升高等)和消化系统症状。应谨慎与其他经肾脏消除的药物合用,肾功能障碍者慎用,肌酐清除率为10~30 mL/min的患儿,应调整治疗剂量。
3.2.2 血凝素抑制剂
盐酸阿比多尔(Arbidol)是血凝素抑制剂,通过以下方式发挥抗病毒作用:(1)通过激活体内2, 5-寡聚腺苷酸合成酶,抑制病毒核酸合成;(2)抑制膜融合,阻碍病毒复制;(3)诱导IFN产生,具有免疫调节作用[47]。体外试验证明阿比多尔对个别DNA病毒,如ADV也有一定抑制作用[48]。
俄罗斯[46]使用阿比多尔治疗2岁以上儿童流感,治疗用法用量如下:2~6岁每次50 mg,6~12岁每次100 mg,>13岁每次200 mg,4次/d,疗程5 d;暴露后预防剂量同治疗剂量,1次/d,连续服用10~14 d;流感季预防剂量同治疗剂量,每周2次,连续服用3周。
目前国内尚缺乏阿比多尔治疗儿童流感的大样本、多中心临床研究证实其安全性和有效性,试用时可参考俄罗斯的推荐治疗方案调整单次剂量。在临床应用进一步评价药物疗效,出现不可耐受的不良反应时应停止使用。
我国研究者曾试用阿比多尔治疗COVID-19患者,其有效性仍需进一步临床研究验证[49-51]。其不良反应主要表现为恶心、腹泻、头晕和血清转氨酶增高。
3.2.3 核酸内切酶抑制剂
巴洛沙韦(Baloxavir)主要通过抑制流感病毒帽子依赖的核酸内切酶活性发挥作用[52]。研究显示,巴洛沙韦对流感症状的缓解率与奥司他韦相当,但抑制病毒效果优于奥司他韦。FDA已批准巴洛沙韦可用于治疗12岁及以上患者的急性单纯性流感,我国尚未上市,但现已进入新药快速审评通道。其用法用量如下[53-54]:症状出现的48 h内单次服用,体质量40~80 kg剂量为40 mg;体质量≥80 kg剂量为80 mg。国内试用时可参考美国治疗方案调整单次剂量。
其不良反应与奥司他韦类似,但发生率略低(20.7%)[52],目前<12岁的儿童尚未评估其安全性和有效性,由于其上市时间尚短,需要更多的临床研究进行疗效和安全性评估。
3.2.4 RNA聚合酶抑制剂
法匹拉韦(Favipiravir)是一种前体药,本身没有抗病毒活性,其进入体内后可快速转化为法匹拉韦核苷三磷酸(M6)形式,M6通过模拟鸟苷三磷酸(GTP)竞争性抑制病毒RNA依赖的RNA聚合酶,从而抑制病毒基因组复制和转录来发挥抗病毒作用;M6还可渗入病毒基因,通过诱发致命性的突变发挥抗病毒作用。目前国内获批的适应证为治疗成人新型或复发流感,成人疗程为5 d,第1天,每次1 600mg,2次/d;从第2天至第5天,每次600 mg,2次/d,口服给药[55]。我国有研究者尝试使用法匹拉韦治疗成人COVID-19患者,其疗效和安全性尚需进一步验证[56-58]。其不良反应为血尿酸增加、腹泻、中性粒细胞计数减少等。儿童用法用量尚不明确。不推荐在儿童病毒感染性呼吸道疾病使用。
3.2.5 离子通道M2阻滞剂
离子通道M2阻滞剂主要包括金刚烷胺(Amantadine)和金刚乙胺(Rimantadine),仅对甲型流感病毒(IAV)有效,但目前监测资料显示IAV对其耐药,国内外流感相关指南均不建议使用[37,41,59]。常见不良反应为眩晕、失眠及恶心、呕吐等消化道症状,另外,该类药物的治疗量和中毒量接近,对婴幼儿和老年人的肝肾功能和神经系统损伤较重[60]。我国药品监督管理局为了保护儿童用药安全,曾提出药物安全警示和要求:部分可用于治疗普通感冒的小儿复方制剂及中成药,如氨金黄敏颗粒、小儿氨酚烷胺颗粒及小儿复方氨酚烷胺片等因含有金刚烷胺或金刚乙胺成分,需要按照强制性要求修改说明书,在“禁忌”项中增加了“因缺乏新生儿和1岁以下婴儿安全性和有效性的数据,新生儿和1岁以下婴儿禁用本品”,将“5岁以下儿童应在医师指导下使用”修订为“5岁以下儿童不推荐使用”。因此在临床诊疗过程中需要注意相关复方制剂中有无该药成分[61]。
3.3 抗DNA病毒药物 3.3.1 核苷类似物
核苷类似物是化学合成的抗病毒药物,其化学结构简单,便于修饰和合成。目前我国批准上市的有更昔洛韦(Ganciclovir)、阿昔洛韦(Acyclovir)、缬更昔洛韦(Valganciclovir)、阿糖腺苷(Adenosine Arabinoside)等。
3.3.1.1 更昔洛韦
更昔洛韦进入细胞磷酸化后竞争性抑制DNA多聚酶,并掺入病毒及宿主细胞DNA中,从而抑制DNA的合成[35]。对CMV、单纯疱疹病毒(HSV)-Ⅰ型、HSV-Ⅱ型、水痘-带状疱疹病毒(VZV)具有抑制作用,是目前CMV感染的首选药物[62-63]。
更昔洛韦治疗CMV性肺炎患儿的用法、用量如下:诱导治疗,每次5 mg/kg,每12 h1次,静脉滴注,持续2~3周;维持治疗,每次5 mg/kg,1次/d,连续5~7 d,总疗程约3~4周[62]。
肾功能不全者详参考用量见表6 [35]。
更昔洛韦常见不良反应为骨髓抑制、皮疹、药物热、消化道反应等;对本药和阿昔洛韦过敏者、严重中性粒细胞和血小板减少者(中性粒细胞<50×109/L或血小板计数<25×109/L)禁用;12岁以下儿童使用应充分权衡利弊[35]。
3.3.1.2 阿昔洛韦
阿昔洛韦进入被疱疹病毒、EB病毒或CMV感染的细胞后,与脱氧核苷竞争病毒胸苷激酶或细胞激酶,从而抑制DNA的合成。临床主要用于治疗HSV感染(包括HSV脑炎)、水痘-带状疱疹、免疫缺陷者水痘,严重水痘并发症,如水痘肺炎[35,42]。
儿童用法、用量[35,42,64]:(1)免疫缺陷者合并水痘或严重水痘并发症,如水痘肺炎,婴儿与12岁以下小儿,按体表面积每次500 mg/m2或按体质量每次10mg/kg,3次/d,每8 h给药1次,静脉滴注,共7~10 d;(2)HSV脑膜炎治疗,婴儿与12岁以下小儿,按体表面积每次500 mg/m2或按体质量每次10 mg/kg,3次/d,每8 h给药1次,静脉滴注,疗程共14~21 d;(3)12岁以上按成人量;(4)小儿最高剂量为每8 h按体表面积500 mg/m2(10 mg/kg)。
我国NMPA对阿昔洛韦引发急性肾衰竭和临床不合理用药给出了药物安全警示,儿童应慎用或在密切监测下使用[65-66]。常见不良反应为注射部位炎症或静脉炎、皮肤瘙痒或荨麻疹、皮疹、消化道症状、蛋白尿、肝肾功能异常等。
3.3.1.3 缬更昔洛韦
缬更昔洛韦是更昔洛韦的前体药物[35],药理作用与更昔洛韦相似。可用于治疗获得性免疫缺陷综合征(AIDS)患儿的CMV性肺炎。缬更昔洛韦具有骨髓抑制、肝毒性、致癌性和生殖系统毒性。主要不良反应有胃肠道反应、粒细胞和血小板减少、中枢系统反应(发热、头痛、失眠等)。由于儿童用药的安全性和有效性不明确,不常规推荐儿童使用本药。在新生儿症状性先天CMV感染中应用缬更昔洛韦,可能有助于改善听力[67]。为了防止低体质量、低体表面积和低血清肌酐水平的儿童过量用药,美国FDA在2010年更新了缬更昔洛韦口服片剂和溶液剂的剂量[68],批准缬更昔洛韦可用于4个月以上器官移植患儿[67,69-71]。
3.3.1.4 阿糖腺苷
阿糖腺苷[35]可用于治疗疱疹病毒感染所致的单纯疱疹性唇炎、龈口炎、脑炎,但儿童用法用量尚不明确。注射用单磷酸阿糖腺苷可引起严重的过敏反应[72]。严重病例报告中过敏性休克、过敏样反应、呼吸困难、发绀等严重过敏反应的病例占该药严重报告数的61.97%。注射用单磷酸阿糖腺苷还可能会引起精神障碍和神经系统损害(占11.54%),主要不良反应表现有震颤、四肢麻木、惊厥、意识障碍、幻觉、错乱等;也可能会发生血液系统损害(占6.25%),主要表现为骨髓抑制、红细胞减少、白细胞减少、血小板数减少等。
国家药品不良反应病例报告数据库中注射用单磷酸阿糖腺苷的报告数量呈快速增长趋势,严重不良反应报告较多,超适应证用药现象比较突出,14岁以下儿童使用注射用单磷酸阿糖腺苷发生不良反应的报告约占80%。因此我国NMPA曾对阿糖腺苷给予了药物安全警示[73-74],目前尚无儿童应用本药物的安全性和有效性的系统研究资料,不推荐在儿童病毒感染性呼吸道疾病使用。
3.3.1.5 西多福韦(Cidofovir)
西多福韦是一种新的抑制DNA聚合酶的抗病毒药物[75],尚未在我国上市。该药可用于CMV感染和HSV感染等疾病[76-78],针对免疫低下儿童的腺病毒肺炎有个案报道[79-81],证实了其对腺病毒的抗病毒活性,但儿童治疗还需要大规模随机对照研究验证其临床疗效和安全性。
不良反应主要为肾毒性,还可导致中性粒细胞减低、眼压减低、发热、头痛、呕吐、贫血等[82-83]。目前无明确针对病毒感染性呼吸道疾病的用法、用量,尚不推荐在儿童病毒感染性呼吸道疾病使用。
3.3.1.6 其他核苷类似物
伐昔洛韦(Valaciclovir)、喷昔洛韦(Penciclovir)、泛昔洛韦(Famciclovir)作用机理相似,均对HSV-Ⅰ型和HSV-Ⅱ型、VZV、EB病毒及CMV有抑制作用。可用于治疗VZV及HSV-Ⅰ型和HSV-Ⅱ型的感染[35,84-85],不良反应与阿昔洛韦相似。但用于儿童患者的安全性和疗效有待证实,用法用量尚不明确,不推荐在儿童病毒感染性呼吸道疾病中使用。
3.3.2 焦磷酸盐类似物
膦甲酸钠(Foscarnet Sodium)[35]为无机焦磷酸盐衍生物,膦甲酸钠不需要被胸腺嘧啶激酶或其他激酶磷酸化,因此在体外对HSVTK缺失突变株和CMVUL97突变株有活性,耐阿昔洛韦的HSV株或耐更昔洛韦的CMV株可能会对膦甲酸钠敏感。体外实验表明其可抑制RSV、HSV-Ⅰ型和HSV-Ⅱ型、VZV、EB病毒、人类疱疹病毒6型和CMV等。可用于对阿昔洛韦耐药的免疫缺陷者的皮肤黏膜HSV感染或带状疱疹病毒感染。不良反应主要为肾毒性,可引起多系统的不良反应,如发热、乏力、恶心、腹泻等。目前尚无儿童相关研究数据,用法用量尚不明确,用药安全性和有效性尚未确立,故儿童用药应仔细评价。
4
展望
近些年,国内外儿童抗病毒药物研发工作有一定进展,研究较多、进展较快的是几种新型RSV感染防治药物,研究结果初步显示新型抗RSV药物具有良好的临床应用前景。新型抗RSV药物主要包括2类:抗体类和融合抑制剂类。目前进入或完成Ⅱ期临床试验阶段的抗体类药物主要包括MEDI8897(MedImmune LLC)和静注免疫球蛋白RI-001(ADMA Biologics)。MEDI8897是通过修饰Fc区延长半衰期的重组IgG1κ单抗,靶向RSV的F蛋白,其在Ⅰ、Ⅱ期临床试验结果中显示具有良好的安全性,半衰期增长至85~117 d,作为预防类抗体具有良好的保护效果。融合抑制剂类抗RSV小分子药物主要作用于病毒与宿主细胞结合及入侵阶段,通过影响RSV融合蛋白F的变构,从而阻断病毒进入宿主细胞,用于RSV感染的治疗。代表药物为Ziresovir(AK0529, Ark Biosciences)、GS-5806(Gilead Sciences)及JNJ-53718678(Johnson&Johnson)等。AK0529对于RSVA和B亚型具有剂量依赖性的强效抗病毒活性,近期完成的国际儿童RSV患者Ⅱ期临床研究结果显示,AK0529具有很强的抗病毒疗效和良好的安全性。
自1974年WHO实施“扩大免疫计划”以来,疫苗的接种明显降低了儿童的死亡率,接种疫苗依旧是预防儿童病毒感染性疾病的重要策略。目前Clinical Trial登记儿童疫苗在研项目共140项,其中病毒疫苗Ⅰ期研究13项,涉及RSV疫苗、COVID-19疫苗等;涉及RSV滴鼻疫苗、埃博拉疫苗和COVID-19疫苗等的Ⅱ、Ⅲ期研究56项;涉及EV71联合流感疫苗和早产儿疫苗免疫等IV期研究32项[86]。
2019年12月起发生的全球性COVID-19疫情提示,人类与病毒的抗争远远还没有结束。儿童作为易感人群,如何合理、有效进行病毒感染性疾病的预防与治疗,从而保护儿童的生命安全,一直都是医务工作者和科研人员关注的热点问题。在临床工作中,应该严格遵循儿童病毒感染性呼吸道疾病抗病毒治疗合理用药规范,强调应根据患儿疾病实际情况、结合病原学检测等辅助检查结果和抗病毒药物的适应证、用法用量等“合理、规范”地使用抗病毒药物。






