HBV RNA的临床价值与应用展望
杨瑞锋 北京大学人民医院,北京大学肝病研究所;丙型肝炎和肝病免疫治疗北京市重点实验室;国家感染性疾病临床医学研究中心分中心 1996年,科学家在慢性乙型肝炎(CHB)患者的外周血中发现HBV RNA;2021年,我国批准了全球第一个用于临床的HBV RNA高敏检测试剂,并被纳入最新专家共识。一个病毒标志物用了1/4世纪实现了从科研到临床的落地。 一、血清HBV RNA的来源与存在形式 今年年初,
杨瑞锋
北京大学人民医院,北京大学肝病研究所;丙型肝炎和肝病免疫治疗北京市重点实验室;国家感染性疾病临床医学研究中心分中心
1996年,科学家在慢性乙型肝炎(CHB)患者的外周血中发现HBV RNA;2021年,我国批准了全球第一个用于临床的HBV RNA高敏检测试剂,并被纳入最新专家共识。一个病毒标志物用了1/4世纪实现了从科研到临床的落地。
一、血清HBV RNA的来源与存在形式
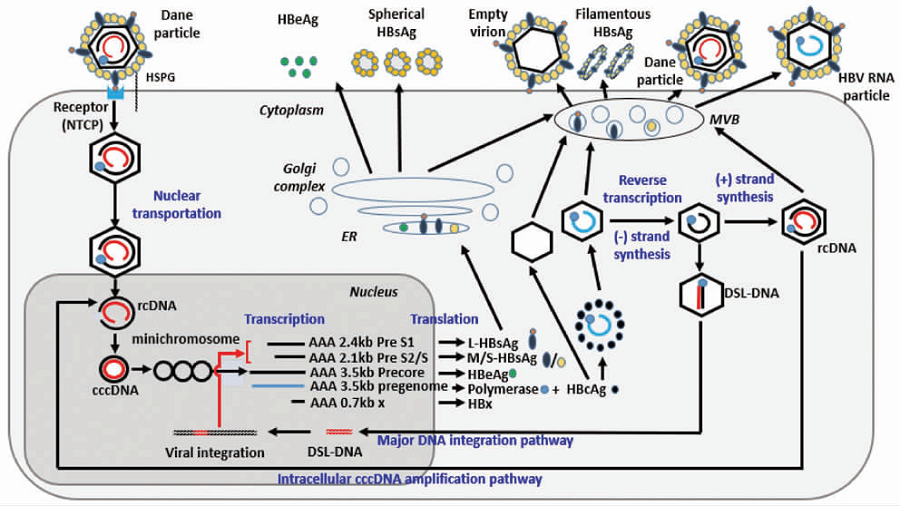
今年年初,南方医科大学孙剑与北京大学鲁凤民教授在Hepatology发表综述,详细介绍了血清HBV RNA的产生及可能的存在形式(图1)[1]。
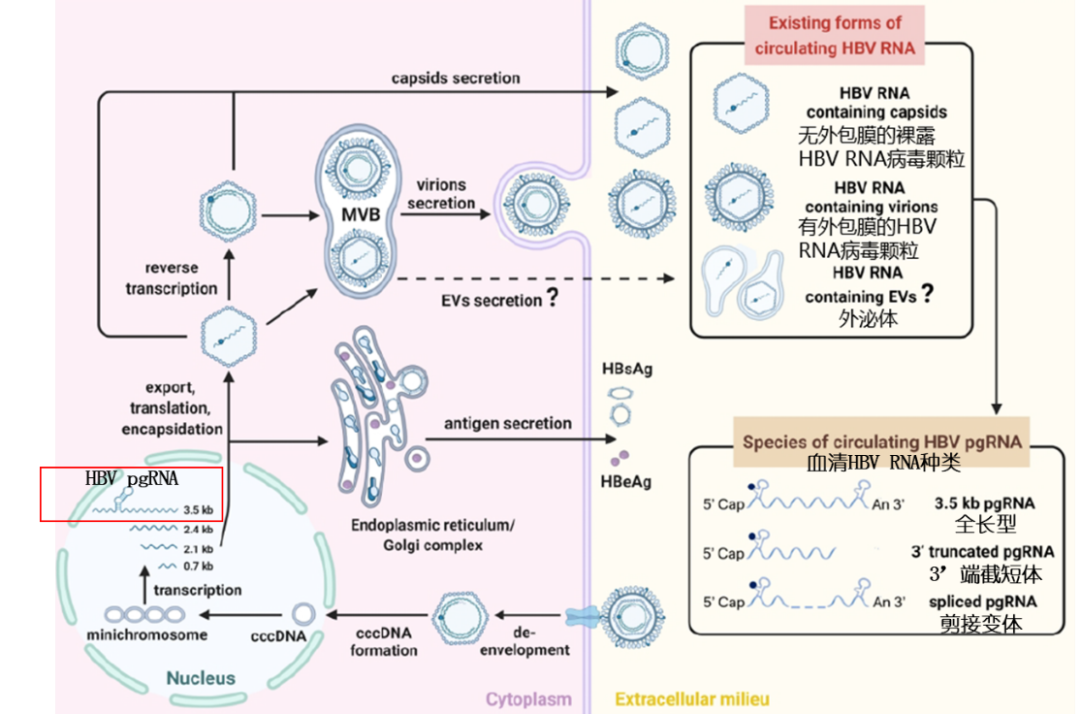
图1.血清HBV RNA的产生及存在形式
共价闭合环状DNA(cccDNA)是HBV的“老巢”,盘踞肝细胞核,转录出4种不同长度的mRNA,包括3.5kb长的前基因组RNA(pgRNA)。pgRNA被核心抗原(HBcAg)构成的核衣壳所包裹,并通过多种途径出胞,进入外周血,我们检测的HBV RNA即pgRNA,但外周血中,除了3.5kb的全长pgRNA及其逆转录残余外,还有不同形式的pgRNA剪接变体和3’端截短体等,所以准确地说,HBV RNA其实是一种混合物,不同试剂品牌使用不同位置的引物和/或探针,检测到的RNA会有差异。
大量研究证实,HBVpgRNA可反映cccDNA的转录活性,这是其临床应用的基础。我们知道,HBV表面抗原(HBsAg)定量也可反映cccDNA活性,但HBsAg既可源于cccDNA的转录和翻译,也可源于整合到人类基因组中的S基因的表达,因此并不能完全准确反映cccDNA的活性,这个意义上说,HBV RNA比HBsAg更准确反映cccDNA活性。
二、HBV RNA的临床意义
1.HBV RNA与纤维化密切相关
复旦大学张文宏教授研究提示,血清HBV RNA水平与CHB患者肝脏炎症活动度和纤维化分期均相关(r=0.665、0.722,P值均<0.001),以2.45log10拷贝/mL作为截断值,血清HBV RNA可有效区分炎症活动度和纤维化评分<2和≥2的标本[曲线下面积(AUROC)=0.88、0.85),且均优于HBsAg的诊断效能[2]。上海市公共卫生临床中心陈良教授团队发表于DiscoveryMedicine的研究显示,无论是HBeAg阳性还是阴性患者,血清HBV RNA水平与显著肝纤维化程度线性相关,且较APRI和FIB-4等2个预测公式能更准确地预测显著肝纤维化进展[3]。
2.HBV RNA可预测肝癌及肝癌术后复发风险
已经有多个研究指出HBV RNA与肝细胞癌(HCC)关系密切,且高于HBV DNA与肝癌的相关性[4-6]。例如,孙剑教授团队发表在The Journal of Infectious Diseases上的研究发现,HBV RNA阳性患者肝癌发生率高于RNA阴性患者(4.11%vs. 1.8%)(图2),并且HBV DNA和HBV RNA“双阴”的患者肝癌发生风险最低,“单阳”患者(HBV DNA或HBV RNA其中之一阳性)比“双阴”患者肝癌发生风险高1.57倍,而HBV RNA/DNA“双阳”患者比“双阴”患者肝癌发生风险高4.02倍[4]。
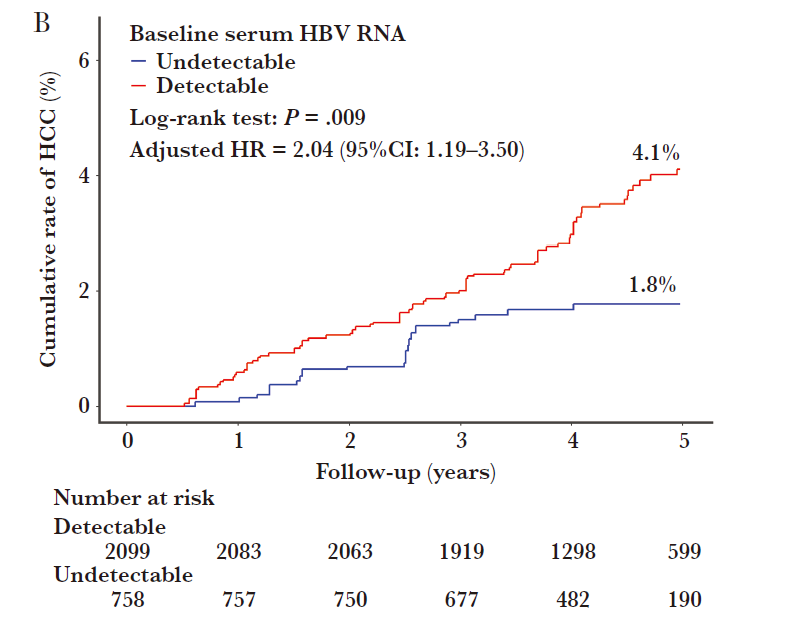
图2.跟踪4.4年HBV RNA阴性组与阳性组的肝癌累计发生率有显著差异
香港大学袁孟峰教授发表在Journal of Gastroenterology上的研究得出类似结论,距发生肝癌小于1年和大于2年这两个时间区段的HBV RNA均与HCC发生相关,且相比HBV DNA,HBV RNA是更强的预测HCC发生的风险因素(表1)[5]。
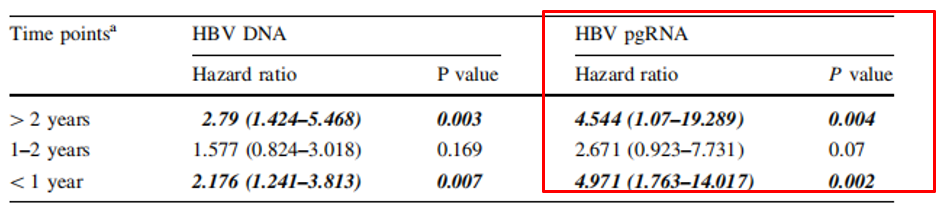
表1.不同时段内HBV DNA和HBV RNA预测肝癌发生风险的比较
东方肝胆外科医院周伟平教授等发表在Hepatology杂志刊文指出,HBV RNA与肝癌术后的复发相关,相比于RNA低值组,高值组患者总体生存率更低,而复发风险更高(图3)[6]。
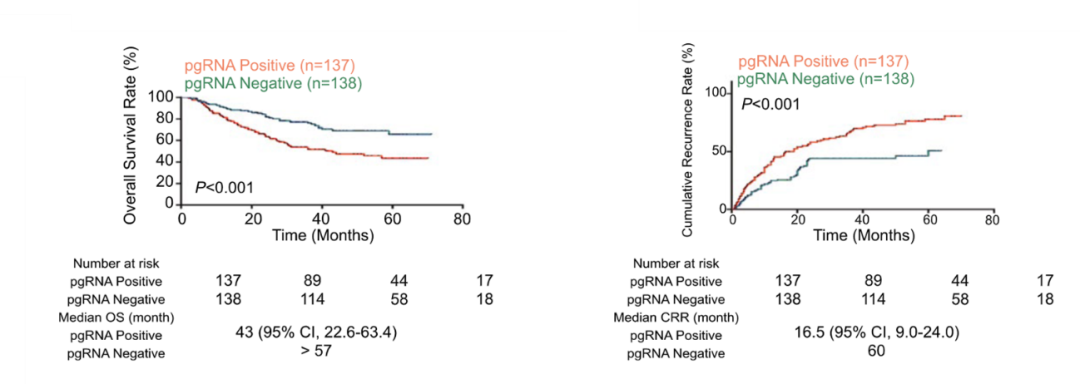
图3.HBV RNA与肝癌术后总生存率和复发风险相关
北京大学庄辉院士团队今年发表在Frontiersin Microbiology的研究,揭示HBV RNA与肝癌术后的复发风险呈正相关,并且远端非癌组织中HBV RNA含量越高,肝癌复发率越高,生存率越低[7]。
由此可见,HBV RNA水平除与肝脏炎症、纤维化程度正相关,可以推测,高水平HBV RNA也可预测HCC的发生,但高水平HBV RNA究竟是仅与HCC存在相关性,还是有因果关系,有待今后更多证据积累。周伟平教授的研究揭示,HBV RNA可能通过与胰岛素样生长因子2mRNA结合蛋白3(IGF2BP3)相互作用,促使HCC的发生和进展,这是对HBV RNA致癌机制研究的一次尝试[6],提示HBV RNA还可能在HCC的发生和进展中扮演重要角色[8]。
3.HBV RNA用于口服核苷(酸)类似物(NAs)病毒学应答的监测并指导停药
随着强效、高耐药屏障的一线NAs(如恩替卡韦、替诺福韦等)的广泛应用,目前大部分CHB患者在接受NAs治疗1年后,HBV DNA就会阴转或处于低病毒血症状态,而HBsAg阴转较为困难,抗原血症时间可长至10年甚至更久。在此期间,HBV RNA作为一个有效反映cccDNA转录活性的替代指标,可覆盖HBV DNA和HBsAg监测的“盲区”,监控抗病毒疗效(图4)[9]。

图4:HBV RNA填补HBV DNA监测盲区
在NAs治疗HBV DNA阴性的患者中,仍有相当比例RNA阳性,随NAs治疗逐步转阴[10]。北京大学徐小元教授研究指出,抗病毒治疗前期HBV RNA阴转较为迅速,但不同NAs的阴转率有所不同[11]。另一项多中心研究提示,HBV RNA存在低水平波动状态,时高时低,时阴时阳,提示应答欠佳[12]。
2018年,美国肝病学会(AASLD)和欧洲肝病学会(EASL)组成的乙肝治疗终点工作组在《乙型肝炎的治疗:从发现到注册审批》报告中指出,在接受NAs治疗的患者血清HBV DNA未检测到的情况下,检测HBV RNA可作为反映cccDNA转录活性的有效替代指标”[13],肯定了HBV RNA在HBV DNA阴性患者中的监测价值。
如何指导NAs停药,也是当下大家关注的热点。停药时HBV RNA高水平患者,停药复发风险也高。例如,南方医科大学彭劼教授2021年发表在Alimentary Pharmacology & Therapeutics的研究指出,NAs停药时,HBV RNA水平≥20000拷贝/mL的患者,100%在停药6年后出现复发,相比之下,停药时HBV RNA水平<1000拷贝/mL的患者,复发比例仅为23.8%(P<0.001)[14]。因此,我们建议HBV RNA阳性患者坚持服药。HBV RNA与其他血清标志物如HBsAg和核心相关抗原(HBcrAg)等联合,进行停药复发风险预测,效果可能更佳[15-17]。而尝试性停药时,若HBV RNA水平较低,则复发风险也相对较低,同时,也有更高几率在停药后清除HBsAg、获得CHB功能性治愈[14]。
HBV RNA应用于停药预测,已被纳入多个指南共识,包括我国《慢性乙型肝炎防治指南(2019年版)》、2017年EASL《乙型肝炎病毒感染管理临床实践指南》、AASLD和EASL联合发表《乙型肝炎的治疗:从发现到注册审批》报告、中华医学会肝病学分会发表的《慢性HBV感染者血清HBV RNA检测及临床应用专家共识(2022)》等[13,18-20]。
4.HBV RNA预测干扰素或NAs治疗的HBeAg和/或HBsAg血清学转换
2019年华中科技大学宁琴教授发表的《慢性乙型肝炎功能性治疗路线图》指出,血清HBV RNA 可作为抗病毒治疗中HBeAg血清学转换的早期预测因子[21]。
HBV RNA在基线、12周及24周均能有效预测聚乙二醇干扰素(PEG-IFN)治疗的HBeAg血清学转换及病毒学复发[22-25]。北京大学王贵强教授、中南大学龚国忠教授在Hepatology International刊文指出,治疗12周HBV RNA<1000拷贝/mL是预测HBeAg血清学转换的最强预测因子(图5)。
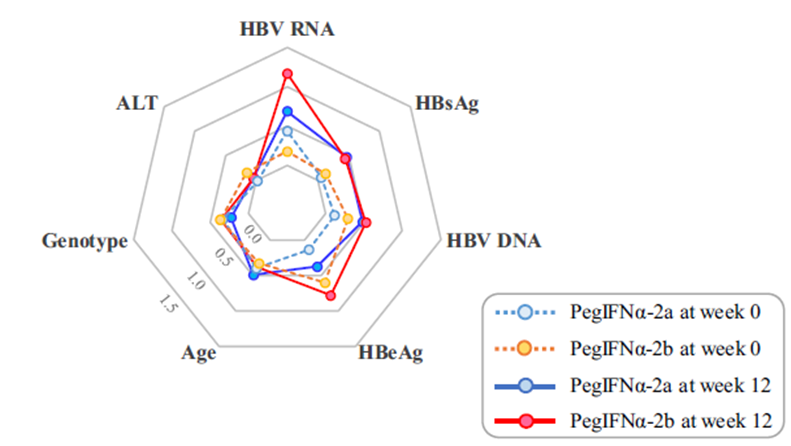
图5. 相比其他标志物,HBV RNA是干扰素治疗HBeAg血清学转换的最佳预测因子
NAs治疗患者基线HBV RNA水平同样与HBeAg清除率和DNA阴转率相关,而NAs治疗12周及24周RNA水平是预测HBeAg血清学转换的最佳预测因子[26-27]。
HBV RNA还可预测PEG-IFN治疗患者HBsAg下降和HBsAg血清学转换。国外一项多中心研究显示,PEG-IFN治疗24周获得HBV RNA应答的患者(即HBV RNA下降>2log10 IU/mL,或下降>1log10 IU/mL且低于检测下限),HBV DNA持续性病毒学应答(sustainedresponse)率和HBsAg转阴率均显著高于未获得HBV RNA 应答的患者(图6)[28]。
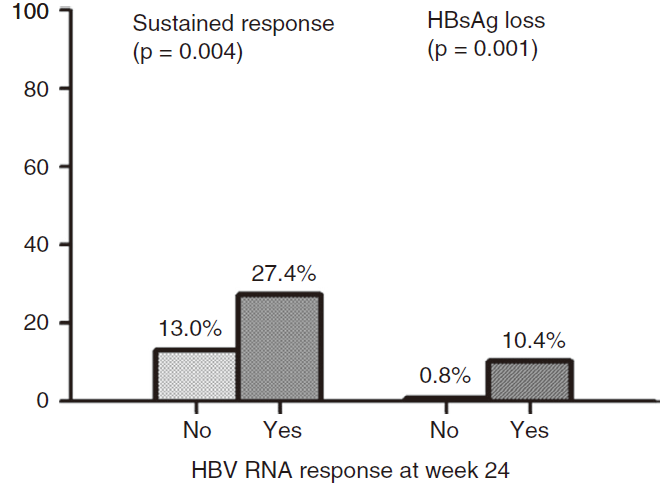
图6.干扰素治疗24周时HBV RNA水平可预测持续性病毒学应答和HBsAg阴转
多伦多大学研究团队发表于Clinical Infectious Diseases的研究得出了类似的结论,PEG-IFN-α治疗12周时,血清HBV RNA水平低的患者,更容易实现HBsAg下降甚至转阴(图7)[25]。

图7.干扰素治疗12周HBV RNA可预测HBsAg下降或清除
HBV RNA水平也可预测NAs停药后HBsAg的消失。前述彭劼教授的研究提示,NAs停药时血清HBV RNA<1000 拷贝/mL的患者,停药后6年后HBsAg清除率显著高于停药时HBV RNA≥1000 拷贝/mL的患者(30.9%vs. 1.6%,P=0.007)[14]。
三、血清HBV RNA检测技术
目前用于定量检测血清HBV RNA的技术包括基于TaqMan探针的反转录-定量聚合酶链反应(RT-qPCR)和实时扩增和检测技术(Simultaneous Amplification and Testing,SAT)(图8)。众多临床检验分子诊断公司采用RT-qPCR技术平台检测RNA,而SAT则是在转录介导的核酸扩增技术(TMA)基础上发展而来,也可对RNA进行荧光定量检测,其优势在于可特异性扩增RNA片段,很大程度上避免了核酸提取产物中HBV DNA对RNA定量的干扰,实验过程中也无需向提取产物中加入DNA酶以消除DNA干扰[20],上海仁度等诊断公司即采用该技术平台。
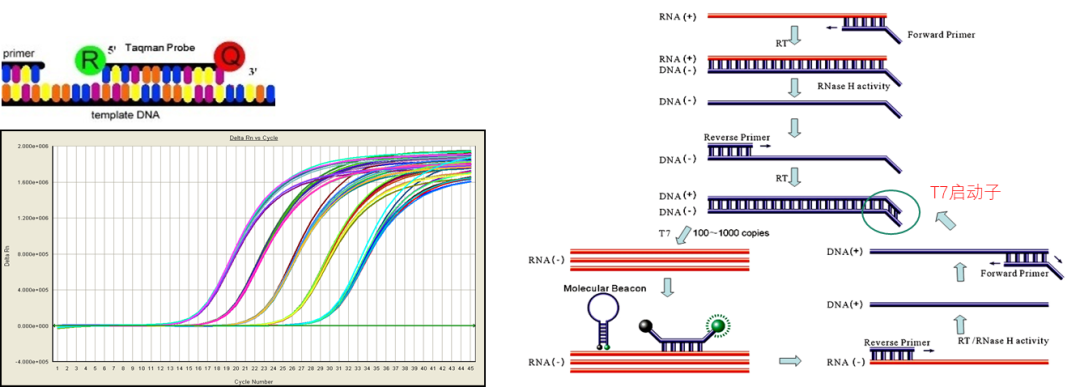
图8:实时荧光定量PCR(左)和SAT(右)技术原理示意图
2021年,我国批准的全球首个用于临床的HBV RNA诊断平台基于SAT技术,该平台从核酸提取到结果报告,可实现全程自动化,减轻操作者负担的同时,更好保证结果的重复性和可靠性,全程自动化也是未来核酸检测的大势所趋。
不同技术检测HBV RNA的灵敏度有所差异。张文宏教授的一项研究收集170例CHB病人血清标本,评估SAT和RT-qPCR检测HBV RNA的性能,结果发现,在HBV DNA<100 IU/mL血清样本中,SAT的HBV RNA检出率为77.27%,而RT-qPCR为59.09%[30]。复旦大学陈良教授团队收集了212例CHB病人的血清标本,在HBV DNA<100 IU/mL的血清样本中,SAT的HBV RNA阳性检出率为98.68%,而RT-qPCR检出率为88.16%[29]。各个检测平台的技术仍在不断优化中,今后需要更多性能评价数据的积累。
四、HBV RNA未来推广应用需要解决的问题
1.检测需进一步标准化
一个成熟的检验项目,需解决标准化问题。我国《慢性乙型肝炎防治指南(2019年版)》指出,HBV RNA研究存在的局限性是,不同研究团队采用的检测方法不完全相同,导致结果缺乏可比性[18]。2019年《EASL-AASLD HBV治疗终点专家会议报告》也提出,推荐对血清HBV RNA的测定进行标准化,以确保仅测量HBV RNA,而不是HBV RNA和DNA的混合[31]。今后需继续优化检测技术,研发国际标准物质,采用国际单位(IU)来表示结果,或提供拷贝数与IU之间的换算系数,以提高结果的溯源性和不同平台之间结果的可比性。
2.医学决定水平有待确认
近年来,不同临床研究提供的具有临床指导意义的HBV RNA水平,存在较大变异。需逐渐形成公认的医学决定水平,使其更切实、便捷地应用于特定临床场景的诊治指导。
3.作为一种多能标志物,如何更好融入既有的诊断体系?
综合近些年的临床研究结果我们可以发现,HBV RNA是一个“全能型”标志物,在CHB治疗监测、肝脏炎症/纤维化和肝癌、肝癌术后复发预测等领域,都展示出较高的价值,但如何与相关领域既有的传统标志物、检测方法和预测模型取长补短,发挥联合诊断的优势,如何挖掘HBV RNA独特的诊断价值,乃至如何选择HBV感染相关的众多血清学/分子生物学标志物组合,在科学应用的同时,又顾及成本效益,这些都是需要解决的问题(图9)。
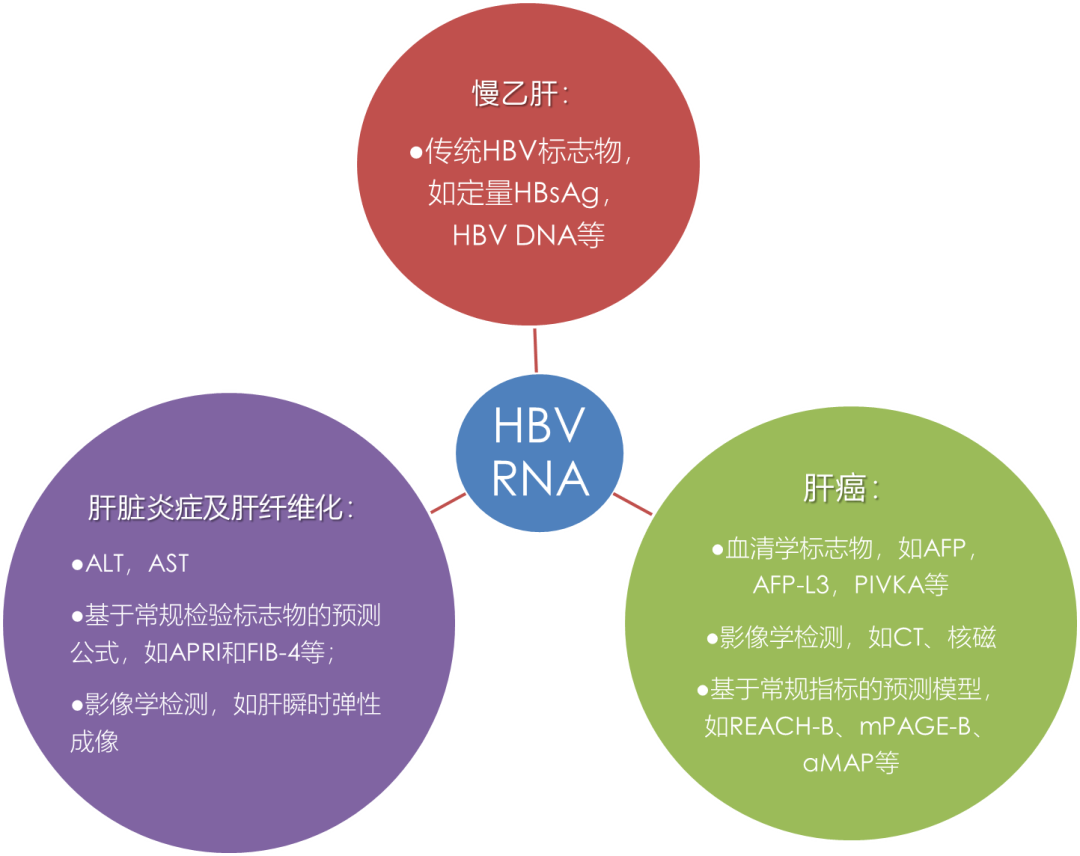
图9.HBV RNA与其他诊断标志物/诊断方法存在合作和竞争关系
致谢:感谢刘兰心(西澳大学生化与分子生物学硕士)在本文撰写中提供的大力支持。
参考文献
[1]DengR, Liu S, Shen S, et al. Circulating hepatitis B virus RNA: Frombiology to clinical applications. Hepatology, 2022. doi:10.1002/hep.32479.
[2]Wang J, Yu Y, Li G, et al. Relationship Between Serum HBV-RNA Levelsand Intrahepatic Viral as Well as Histologic Activity Markers inEntecavir-Treated Patients. Journal of Hepatology, 2018, 68(1):16–24.doi: 10.1016/j.jhep.2017.08.021.
[3]Huang C, Li Q, Xu W, et al. Serum HBV RNA Levels Predict SignificantLiver Fibrosis in Patients with Chronic HBV Infection. Discoverymedicine, 2020.
[4]LiuS, Deng R, Zhou B, et al. Association of Serum Hepatitis B Virus RNAWith Hepatocellular Carcinoma Risk in Chronic Hepatitis B PatientsUnder Nucleos(t)ide Analogues Therapy. The Journal of InfectiousDiseases, 2021. https://doi.org/10.1093/infdis/jiab597.
[5]Mak L, Huang Q, Wong D, et al. Residual HBV DNA and pgRNA viraemia isassociated with hepatocellular carcinoma in chronic hepatitis Bpatients on antiviral therapy. J Gastroenterol,2021, 56(5): 479–488.https://doi.org/10.1007/s00535-021-01780-5.
[6]Ding W, Wang M, Jian Y, et al. HBV‐pgRNA increases the stemness andpromotes the development of HBV‐related HCC through reciprocalregulation with IGF2BP3. Hepatology. 2021, 74(3): 1480–1495.https://doi.org/10.1002/hep.31850.
[7]XiaoY, Cao J, Zhang Z, et al. Hepatitis B Virus Pregenomic RNA ReflectingViral Replication in Distal Non-Tumor Tissues as a Determinant of theStemness and Recurrence of Hepatocellular Carcinoma. Frontiers inMicrobiology, 2022, 13(2):830741–830741.https://doi.org/10.3389/fmicb.2022.830741.
[8]中华医学会肝病学分会肝癌学组.HBV/HCV相关肝细胞癌抗病毒治疗专家共识(2021年更新版).中华肝脏病杂志,2021, 29(10):948-966. doi: 10.3969/j.issn.1001-5256.2021.10.008
[9]LiaoH, Liu Y, Li, X, et al. Monitoring of Serum HBV RNA, HBcrAg, HBsAgand Anti-HBc Levels in Patients During Long-TermNucleoside/Nucleotide Analogue Therapy. Antiviral Therapy, 2019,24(2):105–15, https://doi.org/10.3851/IMP3280.
[10]CareyI, Gersch J, Wang B, et al. Pregenomic HBV RNA and Hepatitis BCore‐Related Antigen Predict Outcomes in Hepatitis B eAntigen–Negative Chronic Hepatitis B Patients Suppressed onNucleos(T)ide Analogue Therapy. Hepatology (Baltimore, Md.), 2020,72(1):42–57, https://doi.org/10.1002/hep.31026.
[11]PanJ, Tian Y, Xu J, et al. Dynamics of Hepatitis B Virus Pregenomic RNAin Chronic Hepatitis B Patients With Antiviral Therapy Over 9 Years.Frontiers in Medicine, 2022, 9: 851717–851717,https://doi.org/10.3389/fmed.2022.851717.
[12]Cortese M, Riveiro-Barciela M, Tabernero D, et al. StandardizedHepatitis B Virus RNA Quantification in Untreated and Treated ChronicPatients: a Promising Marker of Infection Follow-Up. MicrobiologySpectrum, 2022, 10(2):e0214921–e0214921, https://doi.org/10.1128/spectrum.02149-21.
[13]Lok AS, Zoulim F, Dusheiko G, et al. Hepatitis B cure: from discoveryto regulatory approval. J Hepatol, 2017, 67(4):847-861. doi:10.1016/j.jhep.2017.05.008.
[14]XiaM, Chi H, Wu Y, et al. Serum Hepatitis B Virus RNA Level IsAssociated with Biochemical Relapse in Patients with ChronicHepatitis B Infection Who Discontinue Nucleos(t)ide AnalogueTreatment. Alimentary Pharmacology & Therapeutics, 2021,54(5)2021:709–14, https://doi.org/10.1111/apt.16538.
[15]FanR, Zhou B, Xu M, et al. Association between negative results fromtests for HBV DNA and RNA and durability of response afterdiscontinuation of nucles(t)ide analogue therapy. ClinicalGastroenterol Hepatology, 2019, 18(3): 719-727.doi:10.1016/j.cgh.2019.07.046.
[16]FanR, Peng J, Xie Q, et al. Combining hepatitis B virus RNA andhepatitis B core-related antigen: guidance for safely stoppingnucleos(t)ide analogues in hepatitis B e antigen-positive patientswith chronic hepatitis B[J]. Journal of Infectious Diseases, 2020,222(4): 611-618. doi: 10.1093/infdis/jiaa136.
[17]SetoWK, Liu KS, Mak LY, et al. Role of serum HBV RNA and hepatitis Bsurface antigen levels in identifying Asian patients with chronichepatitis B suitable for entecavir cessation. Gut, 2021, 70(4):775-783. doi: 10.1136/gutjnl-2020-321116.
[18]中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版).中华肝脏病杂志,2019,12(27):938-939. doi:10.3760/cma.j.issn.1007-3418.2019.12.007.
[19]EuropeanAssociation for the Study of the Liver. EASL 2017 clinical practiceguidelines on the management of hepatitis B virus infection. Journalof Hepatology, 2017, 67(2): 370-398. doi: 10.1016/j.jhep.2017.03.021.
[20]中华医学会肝病学分会基础医学与实验诊断协作组.慢性HBV感染者血清HBV RNA 检测及临床应用的专家共识.中华肝脏病杂志,2022, 30(5): 505-511. doi: 10.1136/gutjnl-2020-321116.
[21]Ning Q, Wu D, Wang GQ, et al. Roadmap to functional cure of chronichepatitis B: an expert consensus. Journal Viral Hepatitis, 2019,26(10): 1146-1155. doi: 10.1111/jvh.13126.
[22]JiaW, Zhu M, Qi X, et al. Serum Hepatitis B Virus RNA Levels as aPredictor of HBeAg Seroconversion During Treatment with PeginterferonAlfa-2a. Virology Journal, 2019, 16(1): 61–61.https://doi.org/10.1186/s12985-019-1152-6.
[23]ZhangM, Li G, Shang J, et al. Rapidly Decreased HBV RNA Predicts Responsesof Pegylated Interferons in HBeAg-Positive Patients: a LongitudinalCohort Study. Hepatology International, 2020, 14(2): 212–24.https://doi.org/10.1007/s12072-020-10015-3.
[24]Limothai,U, Natthaya C, Kittiyod P et al. Baseline and Kinetics of SerumHepatitis B Virus RNA Predict Response to Pegylated Interferon‐basedTherapy in Patients with Hepatitis B e Antigen‐negative ChronicHepatitis B. Journal of Viral Hepatitis, 2019, 26(12): 1481–88.https://doi.org/10.1111/jvh.13195.
[25]Farag,MS, Margo JH, Van C, et al. Hepatitis B Virus RNA as Early Predictorfor Response to Pegylated Interferon Alpha in HBeAg-Negative ChronicHepatitis B. Clinical Infectious Diseases, 2021, 72(2): 202–11.https://doi.org/10.1093/cid/ciaa013.
[26]LuoH, Tan N, Kang Q, et al. Hepatitis B Virus Pregenomic RNA Status CanReveal the Long‐term Prognoses of Chronic Hepatitis B PatientsTreated with Nucleos(t)ide Analogues. Journal of Viral Hepatitis,2020, 27(3): 323–28. https://doi.org/10.1111/jvh.13227.
[27]Wu,Y, Wen J, Tang G, et al. On-Treatment HBV RNA Dynamic PredictsEntecavir-Induced HBeAg Seroconversion in Children with ChronicHepatitis B. The Journal of Infection, 2021, 83(5): 594–600.https://doi.org/10.1016/j.jinf.2021.08.044.
[28]BrakenhoffS, de Man R, Boonstra A, et al. Hepatitis B Virus RNA Decline WithoutConcomitant Viral Antigen Decrease Is Associated with a LowProbability of Sustained Response and Hepatitis B Surface AntigenLoss. Alimentary Pharmacology & Therapeutics, 2021, 53(2):314–20,https://doi.org/10.1111/apt.16172.
[29]黄晨璐,许伟,胡乾坤,张小楠,李强,黄玉仙,陈良.实时荧光核酸恒温扩增试验和定量反转录-聚合酶链反应对血清乙型肝炎病毒RNA定量检测的一致性评价[J].微生物与感染,2020,15(03):158-165.
[30]张缈曲,张琪然,张寒悦,喻一奇,仇超,张文宏.一种新型乙型肝炎病毒RNA定量检测方法的临床检测性能评估[J].中华传染病杂志,2020,38(12):782-785.
[31]CornbergM, Lok AS, Terrault NA, et al. Guidance for design and endpoints ofclinical trials in chronic hepatitis B-report from the 2019EASL-AASLD HBV treatment endpoints conference(double dagger). Journalof Hepatology, 2020,72(3): 539-557. doi:10.1016/j.jhep. 2019.11.003.