急性呼吸窘迫综合征患者的急性右心室损伤表型分析
急性呼吸窘迫综合征患者的急性右心室损伤表型分析 急性呼吸窘迫综合征(ARDS)患者出现右心室(RV)损伤与增加病死率显著相关,给临床救治带来挑战。最近9项关于ARDS研究(n=1861)的系统综述和荟萃分析发现,21%的患者出现RV损伤,定义为RV功能障碍、急性肺心病(ACP)、RV功能障碍伴血流动力学损伤或RV功能衰竭。这篇最新的文章中,我们旨在讨论ARDS中RV生物力学异常的机制和RV损伤表
急性呼吸窘迫综合征患者的急性右心室损伤表型分析
急性呼吸窘迫综合征(ARDS)患者出现右心室(RV)损伤与增加病死率显著相关,给临床救治带来挑战。最近9项关于ARDS研究(n=1861)的系统综述和荟萃分析发现,21%的患者出现RV损伤,定义为RV功能障碍、急性肺心病(ACP)、RV功能障碍伴血流动力学损伤或RV功能衰竭。这篇最新的文章中,我们旨在讨论ARDS中RV生物力学异常的机制和RV损伤表型特征。了解RV损伤的病理生理学和自然史,有助于为重症医师诊断和监测RV损伤,以及潜在个性化治疗措施提供依据。
一、ARDS中RV损伤的定义和表型
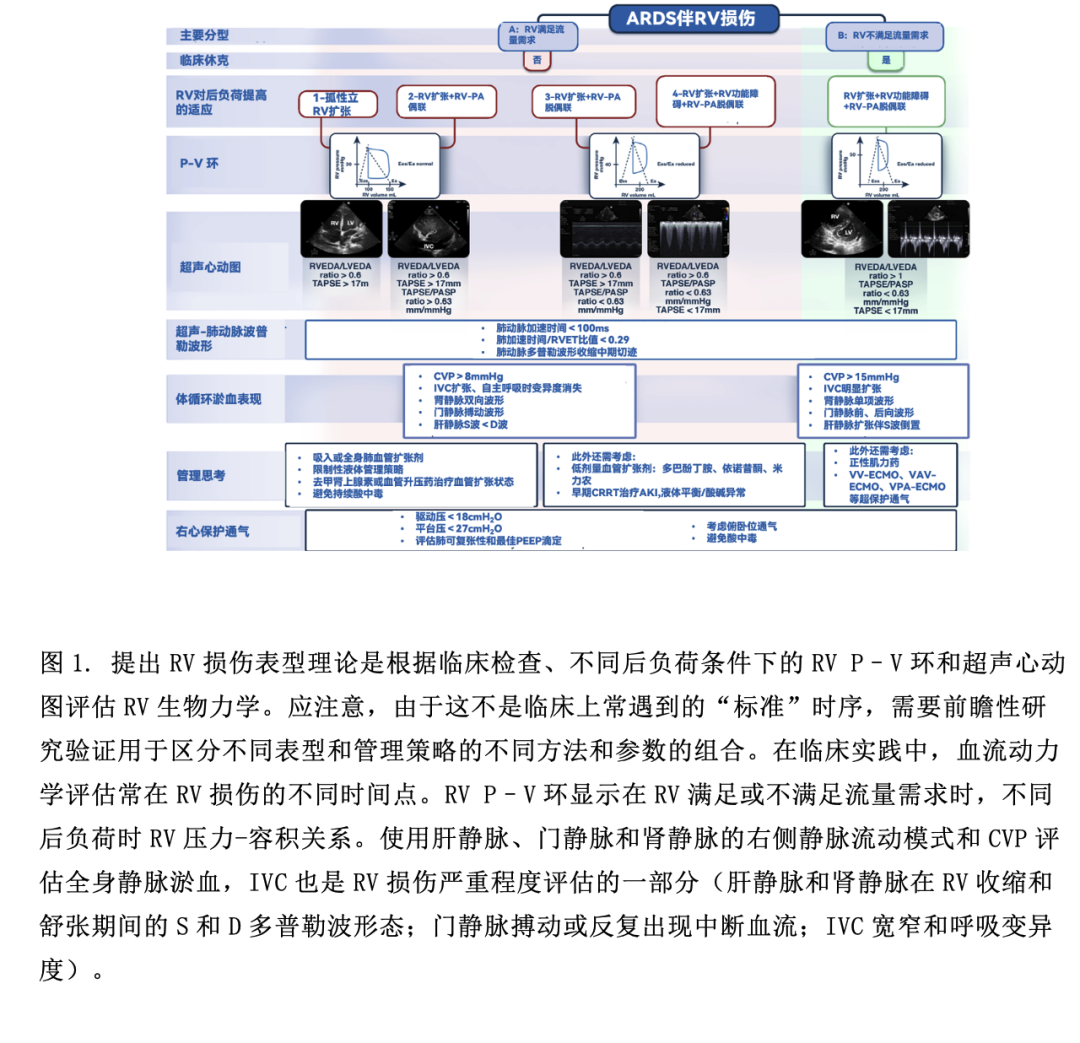
大部分RV损伤的定义聚焦于晚期RV损伤,这种损伤可能已经难以救治。最近在2019新型冠状病毒病(COVID-19)ARDS患者中发现三种不同RV损伤表型(RV功能正常、RV扩张、RV扩张伴收缩功能障碍),这三种表型与不同的临床结局相关。最近一项包括COVID-19相关ARDS患者的多国研究发现,RV损伤的ACP表型[定义为:右、左室舒张末期面积比(RVEDA/LVEDA)>0.6,室间隔运动异常]与增加病死率相关。孤立性RV扩张或RV扩张伴功能障碍,无论是否伴有静脉淤血[中心静脉压力(CVP)≥ 8 mmHg,右侧静脉血流充盈模式:如肝静脉、门静脉和肾静脉或下腔静脉(IVC)宽窄和经超声心动图评估的IVC呼吸变异],RV偶尔可通过Frank–Starling机制代偿来满足流量需求(图1)。在静脉淤血的情况下,由于灌注压(平均动脉压-静脉压)降低,可导致继发器官损伤(肾或肝脏)。尽管早期RV通过Frank–Starling机制代偿,但RV功能进一步损伤、扩张和RV无法满足流量需求会导致休克,进展为晚期RV衰竭。然而,值得注意的是,ARDS中的RV损伤表型、表型终点和随时间推移的表型间转换并无大数据依据。在最初的血液动力学评估和后期RV损伤进程中,尤其是当呼吸功能恶化时,不同阶段RV损伤间可存在相互重叠。这与ARDS中RV损伤的潜在机制有关,即使对RV进行评估(如超声心动图),RV损伤在时间序列上的表型也颇具挑战性。
二、ARDS中RV损伤的机制
1.心血管机制和右心室-肺动脉偶联
不同后负荷下RV和肺动脉(PA)之间相互作用,即RV-PA偶联。其决定了RV收缩性(用收缩末期弹性Ees测量)和PA后负荷(用肺动脉弹性Ea测量)之间的力学融合关系(图1)。应强调的是,RV后负荷指的是肺血管舒缩张力,是阻力和搏动的共同作用,而不仅指肺血管阻力。当Ees/Ea>1时,RV-PA偶联。由于阻塞(血栓形成和肺血管重塑)、压迫(肺水肿和不适当的有创通气)和肺血管收缩(低氧血症、高CO2、酸中毒等)导致急性肺动脉高压(PA)。PA导致RV收缩力增加,以代偿RV后负荷增加(等容代偿或Anrep机制),危重病时,由于全身炎症反应和低血压,这种代偿能力会受限。随后RV扩张以维持血流量(异形代偿),以及Ees/Ea<1(Ea升高引起)导致RV-PA脱偶联,RV和LV舒张之间经跨室间隔相互作用,RV舒张末期压力超过LV舒张末期压力,使LV充盈和心输出量CO降低。由于CO和体循环压力降低,冠脉灌注压降低,以及全身及RV压力降低,导致RV仅舒张期存灌注,从而导致RV心肌缺血。RV和LV之间的跨室间隔相互作用加剧了RV-PA脱偶联,导致体循环休克,RV功能无法满足流量需求(晚期RV损伤或RV衰竭)(图1)。尽管RV-PA脱偶联机制在生理上是合理的,但无法预测从急性等容代偿到异行代偿至失代偿导致晚期RV损伤和休克的临界点。此外,RV对后负荷变化的非线性适应,加上危重症中RV固有收缩功能储备下降,可解释为什么在ARDS中评估不同RV血流动力学/超声心动图表型在时序上表现是一个挑战,使RV损伤成为复杂的临床综合征。
2.心肺“串扰”和医源性机制
右心室后负荷在肺容积极限时最高。严重ARDS患者的功能残气量(FRC)显著降低,当跨肺压超过肺静脉压时,有创通气引起的非生理性应力(跨肺压)和应变(潮气量与FRC比值)会导致RV后负荷升高。肺容积降低会导致终末气道和肺泡外血管塌陷,而肺容积升高时,肺泡壁张力和肺泡内血管塌陷增加,都会导致RV后负荷升高。驱动压(平台压-呼气末正压)≥ 18 cm H2O已确定为中-重度ARDS患者发生ACP的危险因素。此外,在危重症或脓毒性心肌病时,RV固有收缩能力下降会恶化RV功能。
三、多模式诊断和监测RV损伤
可结合超声心动图、肺血流动力学监测和临床检查来评估ARDS中RV收缩力和后负荷的匹配性以及RV对后负荷急性变化的适应过程(图1)。RV-PA偶联可使用超声心动图[三尖瓣环平面收缩偏移(TAPSE)/肺动脉收缩压(PASP)比值]进行无创评估。虽然TAPSE/PASP比值在COVID-19相关ARDS中与RV-PA偶联及临床结局密切相关,但需要多中心前瞻性研究来证明这种相关性。超声心动图衍生的舒张和收缩参数以及使用带有RV监测端口的肺动脉导管监测RV舒张压波形可用于评估RV-PA偶联、严重程度和RV损伤表型。这种方法可以监测RV损伤和肺血管功能障碍的进展,动态评估对治疗的反应。然而,应开展大规模前瞻性研究验证多模式诊断和检测RC损伤的优势。
四、RV损伤管理策略
ARDS中RV损伤的药物治疗包括:改善RV-PA偶联的血管活性药物(如血管扩张剂),通过保持体循环压力高于PA压力来维持冠脉灌注压(如血管加压剂),减少RV后负荷药物(如肺血管扩张剂)(图1)。非药物治疗包括:(a)RV保护性通气;(b) 俯卧位通气;(c)体外膜氧合[(ECMO)静脉-静脉、静脉-动脉-静脉、静脉-肺动脉]。ECMO可以逆转促进RV后负荷增加因素(低氧血症、高CO2、酸中毒)以及降低应力/应变(即“RV保护”通气),有助于卸载“受伤”的RV(图1)。鉴于RV损伤提高病死率以及ECMO可以改善此类患者的病理生理状态,未来的前瞻性研究应评估在选择ECMO支持患者时,是否应针对重度ARDS伴有RV损伤的亚型。上述方法,尤其是机械性辅助RV支持策略,在很大程度上是基于对疾病发生机制和病理生理学的理解,而非循证医学,图1推荐的算法流程仍有待验证。



.jpg)


