首次解析出IgM型B细胞抗原受体的三维结构图
B细胞的表面覆盖着抗原受体,它们用这些受体识别入侵的病原体,如细菌和病毒。当B细胞抗原受体与外来抗原结合时,B细胞被激活并触发抗体的产生。抗体对我们的生存至关重要,并保护我们免受SARS-CoV-2等病原体感染引起的严重疾病。 疫苗接种具有保护作用,因为它们激活了抗原受体,从而引发了免疫反应。在一项新的研究中,来自来自德国弗莱堡大学、美国哈佛医学院和波士顿儿童医院的研究人员公布了IgM型B细胞
B细胞的表面覆盖着抗原受体,它们用这些受体识别入侵的病原体,如细菌和病毒。当B细胞抗原受体与外来抗原结合时,B细胞被激活并触发抗体的产生。抗体对我们的生存至关重要,并保护我们免受SARS-CoV-2等病原体感染引起的严重疾病。

疫苗接种具有保护作用,因为它们激活了抗原受体,从而引发了免疫反应。在一项新的研究中,来自来自德国弗莱堡大学、美国哈佛医学院和波士顿儿童医院的研究人员公布了IgM型B细胞抗原受体的确切分子结构。他们的发现表明,B细胞表面的IgM型受体与其他受体相互作用,从而控制其信号转导。相关研究结果于2022年10月13日在线发表在Nature期刊上,论文标题为“Structural principles of B-cell antigen receptor assembly”。
信号传导亚基与免疫球蛋白连接在一起
B细胞抗原受体由一个结合在细胞膜上的免疫球蛋白(即膜结合抗体)和两个较小的亚基Igα和Igβ组成。一旦B细胞抗原受体识别出病原体,这些较小的亚基就会将信号传导到细胞内部,因而也称为信号传导亚基。论文共同通讯作者、弗莱堡大学生物系的Michael Reth教授说,“这些信号传导亚基究竟是如何与免疫球蛋白连接在一起的,这在以前是未知的。”Reth教授30多年来一直在研究B细胞抗原受体,并且最初发现了它的信号传导亚基。
Reth说,“长期以来,我们没有技术上的可能性来研究膜蛋白的确切结构。如今,低温电子显微镜使我们能够解析出高分辨率的B细胞抗原受体的结构图。”
在低温电镜中,待研究的蛋白分子被非常迅速地冷却到零下183℃。这减少了它们的自然运动,防止了会破坏蛋白结构的微小冰晶形成。通过这种方式,有可能实现比其他电子显微镜方法高许多倍的分辨率。
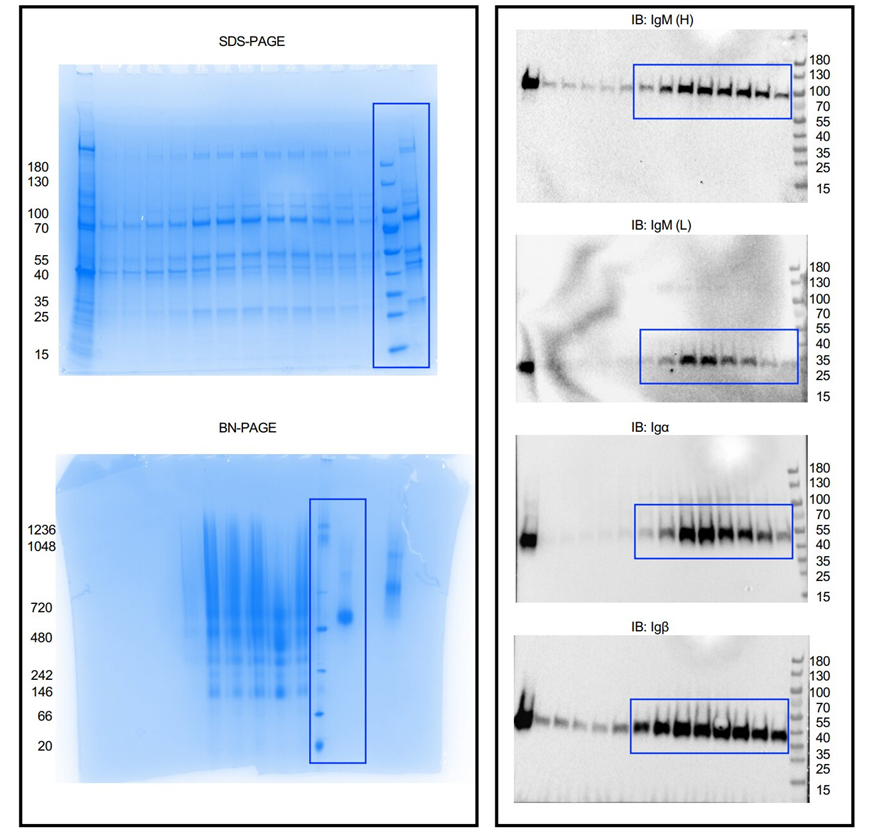
未经裁剪的SDS-PAGE凝胶和免疫印迹。图片来自Nature, 2022, doi:10.1038/s41586-022-05412-7。
在这项新的研究中,这些作者实现了3.3埃的分辨率,这相当于只有几个原子的宽度。为了做到这一点,他们将整个B细胞抗原受体的数十万张图片与它的缺少两个灵活区域的截断版的图片相结合。他们随后利用这些数据在计算机上计算出B细胞抗原受体的完整三维结构。
对称的膜结合抗体只在一侧结合
这种三维结构的引人注目之处在于,这种对称的膜结合抗体只在一侧与Igα和Igβ结合,从而形成一个不对称的复合物。这种不对称性与T细胞受体相似,T细胞受体是另一种重要的免疫受体,其结构于2019年首次被阐明。
Reth解释说,“令人震惊的是,这两种类型的抗原受体都形成了不对称的复合物。这使我们得出结论,如今阐明的这种三维结构是一个更大的受体复合物的一部分,它与B细胞表面的其他分子相互作用。”
这种更大的结构是通过不太强大的力量保持在一起的,还不能用低温电镜等技术来研究。然而,这种新发现的B细胞抗原受体三维结构提供了进一步的证据,支持它与其他分子的这种相互作用:它显示B细胞抗原受体的外部包含保守的氨基酸。如果氨基酸在进化过程中几乎没有变化,因此在不同有机体的抗原受体中是相同的,则被描述为保守的。
Reth说,“朝向外部的保守氨基酸的存在表明,IgM型B细胞抗原受体有进一步的结合伴侣。换句话说,到目前为止,我们只知道这种分子机器的一部分,如今我们想确定其他的组成成分,并确定它们如何影响这种B细胞抗原受体的信号传导效应。”
这些其他的组成成分可能解释了B细胞抗原受体通常如何保持静止状态,只有当它与抗原结合时才被激活。Reth总结道,“这将是适应性免疫研究的下一个重要任务之一。对B细胞激活的更好理解也可能有助于我们进一步改善疫苗的开发,或者理解B细胞抗原受体以不受控制的方式被激活的淋巴瘤的形成。”(生物谷 Bioon.com)
参考资料:
Ying Dong et al. Structural principles of B-cell antigen receptor assembly. Nature, 2022, doi:10.1038/s41586-022-05412-7.







