1例肝移植术后巨细胞病毒合并支气管鲍特菌引起肺炎
前言 肝移植术后感染是导致肝移植患者死亡的重要原因。研究结果显示,约67%的肝移植患者会出现移植术后感染[1],并且部分重症感染患者起病急,发展迅速,病原体复杂,病死率极高。因此,快速准确的鉴定病原体,制定针对性抗感染治疗方案,有重要的临床意义。 本文报道1例肝移植术后肺炎患者的抗感染治疗过程。本病例根据实验室检查确定患者为巨细胞病毒(CMV)合并支气管鲍特菌(Bordetellabronchi
前言
肝移植术后感染是导致肝移植患者死亡的重要原因。研究结果显示,约67%的肝移植患者会出现移植术后感染[1],并且部分重症感染患者起病急,发展迅速,病原体复杂,病死率极高。因此,快速准确的鉴定病原体,制定针对性抗感染治疗方案,有重要的临床意义。
本文报道1例肝移植术后肺炎患者的抗感染治疗过程。本病例根据实验室检查确定患者为巨细胞病毒(CMV)合并支气管鲍特菌(Bordetellabronchiseptica)引起的肺炎。支气管鲍特菌是一类专性需氧的革兰阴性球杆菌,可感染多种哺乳动物,近年来有人类感染的报道,主要发生在免疫缺陷人群中[2-4]。本文就此病例及相关文献进行复习并讨论。
案例经过
患者,男,57岁,因“肝移植术后2月余,喘憋伴乏力1周”于2020年12月10日入院。现病史:患者于2020年10月1日因“不明原因肝硬化失代偿期”行原位肝移植术,手术顺利,术后恢复顺利,常规抗排斥治疗。
患者于1周前无明显诱因出现喘憋伴乏力,病程中未发热,偶咳稀薄白痰,呼吸急促,呼吸频率20次/分,面色苍白,饮食睡眠差。患者为进一步诊疗入我院肝胆胰外科。
入院查体:T36.5℃,P102次/分,R20次/分,BP102/61mmHg。患者面色苍白,口唇干燥。胸廓前后径未见异常,双肺可闻及湿罗音,右肺下叶重,双肺呼吸音减弱,右上腹见陈旧性手术疤痕,无压痛、反跳痛、肌紧张,脾脏未触及,肠鸣音4次/分。双下肢不肿。
实验室检查:白细胞计数(WBC)3.76×109/L,中性粒细胞百分比(NE%)0.34,血红蛋白(HGB)90g/L;超敏C反应蛋白(hs-CRP)19.46mg/L,降钙素原(PCT)0.49ng/mL;血清肌酐(Cr)97.6μmol/L;门冬氨酸氨基转移酶(AST)136.2U/L,丙氨酸氨基转移酶(ALT)127.8U/L,γ-谷氨酰转肽酶(γ-GTP)76.3U/L,总胆红素(TBIL)7.4μmol/L;真菌(1,3)-β-D-葡聚糖159.04pg/ml,曲霉半乳甘露聚糖0.56μg/L。
2020年12月9日肺CT提示:(1)双肺急性弥漫性间质性炎变,考虑病毒感染所致,右肺下叶合并细菌感染可能性大;(2)右侧胸腔积液,以肺底部为主伴邻近右肺下叶部分肺不张。诊断:间质性肺炎、右侧胸腔积液、肝移植术后。
患者入院后,初始给予经验性抗感染方案:头孢哌酮/舒巴坦3g,q12h, ivgtt、万古霉素1g,q12h, ivgtt、米卡芬净100mg, qd, ivgtt、更昔洛韦0.3g,q12h,ivgtt。给予他克莫司抗排斥、补液等对症支持治疗。
患者一般状态较差,呼吸困难,面罩吸氧下血氧饱和度97%,喘憋症状明显,活动耐力差。12月15日,CMV核酸定量检测为5.25×109 copies/L。考虑到患者肺炎较重,于12月16日加用膦甲酸钠3g,q8h, ivgtt协同抗CMV治疗。
患者呼吸乏力有所改善,12月19日血气分析及感染标志物检查:乳酸0.9mmol/L,pH 7.5,SO2 97%,WBC 3.80×109/L,NE% 0.26,hs-CRP 6.08mg/L,PCT 0.14ng/mL。12月20日,患者再次出现呼吸急促,喘憋症状较明显,伴有四肢不自主颤抖,普通面罩吸氧下PO2
59mmHg,SO2 92%,偶咳黑色痰。呼吸音急促较粗,无明显干湿啰音。手指末梢可见轻度发绀。患者改为储氧面罩下吸氧。复查肺CT示:双肺急性弥漫性间质性炎变,较前片左肺炎症略减轻,右肺炎症略加重(见图1)。
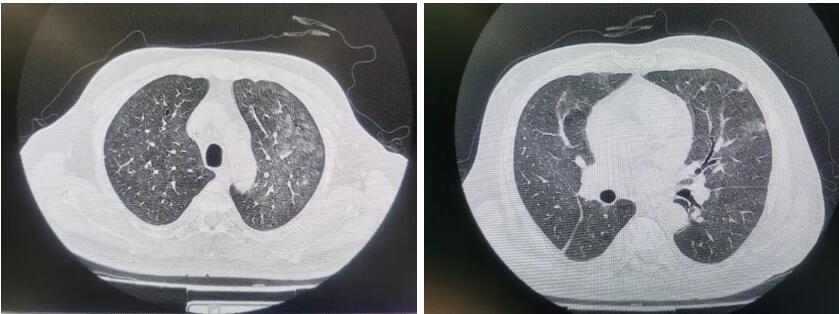
图1 患者2020年12月14日(左)及12月20日(右)肺CT检查结果
患者入院后痰涂片、痰培养、血培养均阴性。12月21日,患者痰液mNGS检测回报支气管鲍特菌(序列数76097)、巨细胞病毒(序列数1797)、白假丝酵母菌(序列数69);血液mNGS结果回报巨细胞病毒(序列数4096)。
综合患者mNGS结果,加用阿奇霉素抗支气管鲍特菌治疗,停用万古霉素,继续应用头孢哌酮/舒巴坦、米卡芬净、更昔洛韦及膦甲酸钠。12月25日,患者一般状况差,呼吸急促,喘憋症状较明显,四肢不自主颤抖持续加重,咳嗽,咳痰,痰中有血。
复查CMV核酸定量检测为低于检测下限,停用膦甲酸钠。将阿奇霉素调整为亚胺培南0.5g,q6h,ivgtt抗支气管鲍特菌感染。第二日,患者自觉呼吸急促、喘憋症状较前改善,不自主颤抖较前改善。12月31日,患者一般状况尚可,呼吸困难症状较前明显好转,饮食睡眠良好。复查肺CT示肺部炎症较前明显减轻(见图2)。
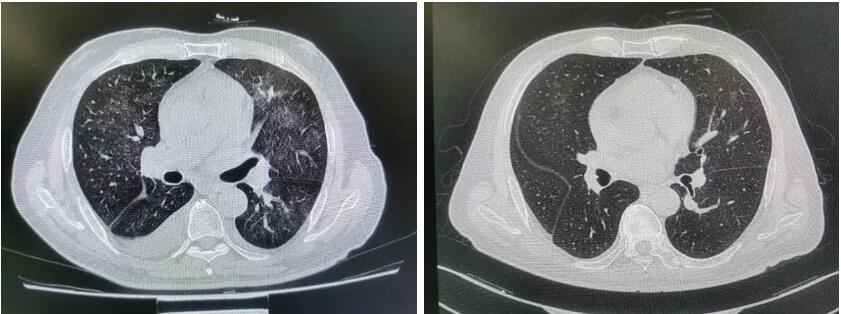
图2 患者2020年12月25日(左)及12月31日(右)肺CT检查结果
2021年1月4日,复查痰液mNGS回报支气管鲍特菌(序列数6274)、白假丝酵母菌(序列数1666)、巨细胞病毒(序列数71)。将亚胺培南降级为阿莫西林/克拉维酸钾(阿莫西林0.2g/克拉维酸0.0285g)4片,q12h, po序贯治疗,卡泊芬净和更昔洛韦继续应用。
1月7日复查WBC 3.45×109/L,NE% 0.52,Cr 99 μmol/L,AST 16.4 U/L,ALT 9.2 U/L,真菌(1,3)-β-D-葡聚糖159.04pg/ml。患者无发热,咳嗽、咳痰症状较轻,于1月7日出院,出院用药阿莫西林/克拉维酸钾、更昔洛韦、他克莫司。后期随访患者预后良好(图3)。
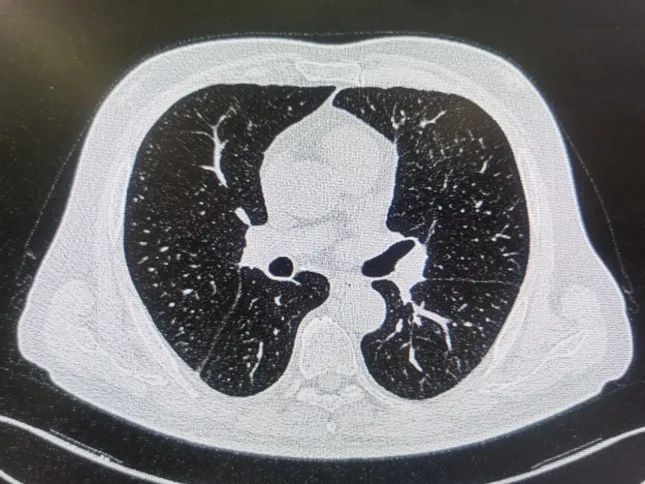
图3患者2021年1月20日肺CT复查结果
案例分析
临床案例分析
肺部感染是肝移植术后最常见的并发症之一,包括细菌感染、真菌感染、病毒感染等。肝移植术后肺部感染早期表现不典型,病原体不明确,临床上常给予经验性多药联合抗感染方案,待病原体明确后及时调整为目标性抗感染方案。患者接受免疫抑制治疗,常并发罕见病原体感染或多种病原体感染,常规病原学培养检出率不高。
本例患者病原体培养、特异性聚合酶链反应和免疫学检测结果均呈阴性,影像学表现特异性差,因此确定病原体类型成为诊疗过程的重点与难点。目前为止,病原体培养被认为感染诊断的“金标准”,但并非所有病原体均适合培养,此外培养耗时长,阳性率低。
特异性聚合酶链反应和酶联免疫吸附实验仅可针对特定病原体进行检测,但临床表现及影像学表现常难以预先假定特定病原体。本例患者通过CMV核酸以及mNGS确定主要病原体为CMV及支气管鲍特菌。
治疗过程中,首先予以患者积极抗感染及支持治疗,维持内环境稳定,患者食欲差,进食量少,给予足量静脉营养,保持能量供应。输血改善患者氧合能力;其次,患者感染重,病情进展迅速,停用他克莫司,减弱免疫抑制强度,增强免疫功能;最后,根据mNGS结果调整抗感染治疗方案。
肝移植术后用药涉及较广,需要抗细菌、真菌、病毒及护肝与和营养支持等多方面联合治疗,临床药师可协助医生为患者优化药物治疗方案。本病例患者在明确病原前,由于患者肺部感染以间质性改变为主,且CMV核酸定量水平较高,应高度警惕CMV肺炎,在更昔洛韦抗感染效果欠佳情况下,临床药师建议联用膦甲酸钠协同抗病毒治疗,以覆盖更昔洛韦耐药性CMV感染[5]。
在通过mNGS确定感染病原后,临床药师初始建议针对鲍特菌加用一线大环内酯类阿奇霉素[6]抗感染治疗,在对国内外文献进行充分循证[4,7-8],发现支气管败血鲍特菌对大环内酯类耐药后,结合患者当前抗感染治疗效果,及时建议医生将阿奇霉素调整为亚胺培南。调整抗感染治疗方案后,患者肺部感染控制良好,抗感染治疗有效。
检验案例分析
mNGS是新兴的病原体诊断手段,可检测血液、痰液、肺泡灌洗液、腹水等多种临床样本。免疫抑制或免疫缺陷患者,常并发多种病原体感染,并且部分病原体难以培养,mNGS可检测临床样本中所有类型的病原体(细菌、真菌、病毒及寄生虫等)的核酸片段,同传统检测技术相比,mNGS的应用可避免漏诊。
同时,同传统方法相比,mNGS敏感度更高,常有多个阳性结果,无法区分污染菌、定植菌及致病菌,需结合临床分析,找出最有可能的致病菌[9-10]。本病例患者痰涂片及培养均呈阴性,经验性用药后对患者效果不佳,采用mNGS解决了病原体鉴定这一难题,使治疗更有针对性。
知识拓展
鲍特菌是一类专性需氧的革兰阴性球杆菌,在目前已发现的9种鲍特菌中,百日咳鲍特菌、副百日咳鲍特菌常与人类感染相关。而支气管鲍特菌主要是啮齿类动物、猪和家庭宠物的致病菌,与百日咳鲍特菌及副百日咳鲍特菌常黏附于带有纤毛的人类呼吸道上皮不同,支气管鲍特菌优先黏附在动物呼吸道上皮[11],尽管人类经常暴露于这种机会性致病菌,但人类感染支气管鲍特菌极为罕见,仅见于少量个案报道,这些病例多为感染动物接触免疫功能低下的宿主,包括艾滋病患者[12-13]、肾移植患者[14]及恶性肿瘤患者[15]等,多数为呼吸道感染,少数引起血流感染[14]、脑膜炎[16]等。
虽然本例患者没有动物接触史,但肝移植患者接受高水平的免疫抑制治疗,对于支气管鲍特菌的易感性并不意外。针对鲍特菌属中常见的百日咳鲍特菌、副百日咳鲍特菌,大环内酯类是一线治疗用药,临床上多使用红霉素,而阿奇霉素和克拉霉素同样有效且病人耐受性更好[6]。然而,支气管鲍特菌容易对大环内酯类产生耐药[4],可产生β-内酰胺酶,对多种青霉素类和头孢菌素类耐药,因此,β-内酰胺酶抑制剂对其一般有效[8]。
文献报道支气管鲍特菌大多数分离株对磺胺甲恶唑/甲氧苄啶表现不同程度耐药,而对阿莫西林克拉维酸钾、哌拉西林他唑巴坦、美罗培南、亚胺培南、四环素类、庆大霉素和喹诺酮类表现敏感。
案例总结
本病例为肝移植术后患者,免疫抑制人群,术后2个月出现喘憋伴乏力,肺CT示双肺急性弥漫性间质性炎变,感染病原体不明。经过常规抗细菌、真菌和病毒联合治疗后肺部感染未予好转,呼吸困难加重。后经mNGS检查确定病原体为CMV合并支气管鲍特菌,调整抗感染治疗方案,患者感染控制。
肝移植术后部分重症感染的患者起病急,发展迅速,病原体复杂,病死率极高。因此,快速明确病原体,制定合理的抗感染治疗方案,对临床有着重要意义。对于罕见菌的治疗,检验、药学应积极辅助临床明确病原并优化抗感染用药方案。通过多学科交叉合作,可提高复杂疾病诊治的有效率,保障患者生命健康。
专家点评
免疫抑制的患者可能发生罕见病原体感染,但常规病原学培养检出率不高。支气管鲍特菌作为临床罕见病原体,由于传统培养需要特殊培养基,因此不容易培养鉴定。mNGS通过对临床样本中微生物和宿主核酸的测序分析,可以无偏倚地检测多种病原微生物,对于新发或少见病原微生物的检出具有重要价值,正在逐渐应用于临床感染性疾病病原检测。本病例使用mNGS确认感染病原体,在检验、药学、临床等多学科合作下,确认病原体,优化抗感染方案,使患者治愈出院。检验、药学、临床等多学科合作对临床抗感染治疗将有很好的推动作用。
【参考文献】
[1]EuropeanAssociation for the Study of the Liver. Electronic address:easloffice@ easloffice. eu. EASL Clinical Practice Guidelines: LiverTransplantation[J]. J Hepatol, 2016, 64(2): 433-485.
[2]牛冬梅,周万青.痰中分离出支气管败血鲍特菌1例[J].中国实验诊断学,2015,19(1):145.
[3]ViejoG, de la Iglesia P, Otero L, et al. Bordetella bronchiseptica pleuralinfection in a patient with AIDS[J]. Scand J Infect Dis, 2002, 34(8):628-629.
[4]WernliD, Emonet S, Schrenzel J, et al. Evaluation of eight cases ofconfirmed Bordetella bronchiseptica infection and colonization over a15-year period[J]. Clin Microbiol Infect, 2011, 17(2): 201-203.
[5]石炳毅, 肖漓,孙丽莹.器官移植受者巨细胞病毒感染临床诊疗规范(2019版)[J].器官移植,2019..
[6]马小军,徐英春,刘正印.ABX指南:感染性疾病的诊断与治疗(第二版)[M].北京:科学技术文献出版社,2016:276-279.
[7]董卫,马雅静,赵海军.从痰标本中分离出1株多重耐药的支气管败血鲍特菌[J].临床检验杂志,2004,22(5):343.
[8]Kadlec K, Schwarz S. Antimicrobial Resistance inBordetellabronchiseptica[J]. Microbiology Spectrum,2018,6(4).
[9] 陆瀚澜,隋明星,赵闻雨,等.高通量二代基因测序技术在器官移植术后肺部感染病原诊断的应用观察[J].中华器官移植杂志,2020,41(7):388-392.
[10] 王鑫,栗光明,林栋栋,等.肺泡灌洗液的高通量测序在肝移植后肺部感染的病原学诊断中的应用[J].中华器官移植杂志,2020,41(8):492-495.
[11] Ducours M, Rispal P, Danjean M P, et al. Bordetellabronchiseptica infection[J]. Médecine et MaladiesInfectieuses,2017,47(7):453-458.
[12] Rampelotto R F, H?rner A, Hrner C, et al. Pneumonia caused byBordetella bronchiseptica in two HIV-positive patients[J]. Sao PauloMedical Journal,2016,134(3):268-272.
[13] Sameed M, Sullivan S, Marciniak E T, et al. Chronic cough andcystic lung disease caused byBordetella bronchisepticain a patientwith AIDS[J]. BMJ Case Reports,2019,12(4):e228741.
[14] Powers H R, Shah K. Bordetella bronchiseptica bloodstreaminfection in a renal transplant patient[J]. Transplant InfectiousDisease,2017,19(6):e12774.
[15] Monti M, Diano D, Allegrini F, et al. Bordetella bronchisepticapneumonia in a patient with lung cancer; a case report of a rareinfection[J]. BMC Infectious Diseases,2017,17(1).
[16] Radcliffe C, Lier A, Doilicho N, et al. Bordetellabronchiseptica: a rare cause of meningitis[J]. BMC InfectiousDiseases,2020,20(1).






