新洞察!双重条件CRISPR-CAS9系统激活基因编辑并减少人干细胞的非靶向效应
CRISPR-Cas9系统起源于细菌内源性适应性免疫系统,其中入侵病毒的DNA序列(聚集的规则间隔的短回文重复序列,CRISPR)整合到细菌基因组中。这些CRISPR序列与Cas核酸酶结合可用于识别和切割来自同一病毒后续感染的外源DNA序列。 Cas9核酸酶来源于化脓性链球菌,研究最广泛。在不同类型的Cas核酸酶中,CRISPR-Cas9系统属于II型。 图片来源:https://doi.or
CRISPR-Cas9系统起源于细菌内源性适应性免疫系统,其中入侵病毒的DNA序列(聚集的规则间隔的短回文重复序列,CRISPR)整合到细菌基因组中。这些CRISPR序列与Cas核酸酶结合可用于识别和切割来自同一病毒后续感染的外源DNA序列。
Cas9核酸酶来源于化脓性链球菌,研究最广泛。在不同类型的Cas核酸酶中,CRISPR-Cas9系统属于II型。

图片来源:https://doi.org/10.1016/j.omtn.2022.04.013.
近日,来自美国国立卫生研究院的研究者们在Molecular Therapy: Nucleic Acids杂志上发表了题为“A dual conditional CRISPR-Cas9 system to activate gene editing and reduce off-target effects in human stem cells”的文章,该研究揭示了双重条件CRISPR-CAS9系统可以作为一种有价值的工具来系统地描述和识别各种病理过程的基因。
CRISPR-CAS9系统已经成为一种强大而高效的基因组编辑工具。CRISPR-Cas9系统的一个重要缺陷是当Cas9内切酶及其sgRNA共表达时,存在结构性内切酶活性。这种结构性活动导致了不受欢迎的非靶点效应,阻碍了使用该系统的研究,例如探测基因功能或其在人类中的治疗用途。
在这里,研究者描述了一种方便的方法,通过结合对Cas9表达的转录调控和对Cas9在人类干细胞中的蛋白质稳定性控制,允许对CRISPR-Cas9的活性进行时间和严格的控制。为了实现这一双重控制,研究者将多西环素诱导的转录调控系统与FKBP12衍生的不稳定结构域融合到Cas9中,以调节蛋白质的稳定性。
研究者发现,当只应用两个对照中的一个时,观察到大约5%-10%的Cas9表达。通过两个系统的结合,研究者显著降低了Cas9的基线表达,并限制了Cas9内切酶在细胞中的暴露时间,导致很少或没有不良的靶向或靶外影响。
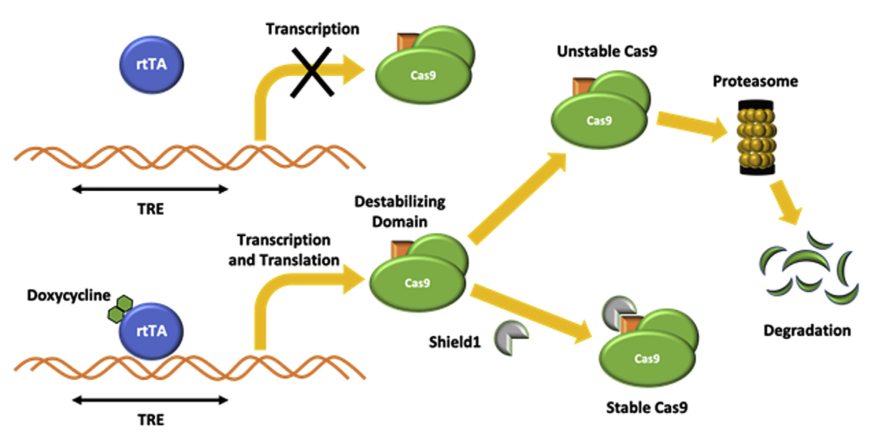
双重条件CRISPR-CAS9系统的机制
图片来源:https://doi.org/10.1016/j.omtn.2022.04.013
综上所述,研究者工作表明,结合两个条件系统,保持了CRISPR-Cas9的有效基因组编辑活性,并通过最小化背景表达和控制Cas9内切酶的暴露时间来减少非目标影响。该研究证实了这个双重条件的CRISPR-CAS9系统可能能够为系统地研究和鉴定参与发育过程的基因提供一个有价值的平台。(生物谷Bioon.com)
参考文献
Seung Bum Park et al. A dual conditional CRISPR-Cas9 system to activate gene editing and reduce off-target effects in human stem cells. Mol Ther Nucleic Acids. 2022 Apr 27;28:656-669. doi: 10.1016/j.omtn.2022.04.013.



.jpg)


