吡咯替尼治疗乳腺癌脑转移,患者获益明显
北京时间1月25日,由河南省肿瘤医院闫敏教授牵头的吡咯替尼联合卡培他滨治疗HER2阳性乳腺癌脑转移的研究成果正式全文在线发表于国际权威医学期刊《柳叶刀肿瘤学》(《Lancet Oncology》,影响因子41.32)。研究结果显示吡咯替尼联合卡培他滨耐受性良好,对颅内、外病灶均能有效抑制,尤其是既往未经治疗的脑转移患者获益明显[1]。 本研究是首个在全部入组人群均为HER2阳性乳腺癌脑转移患者
北京时间1月25日,由河南省肿瘤医院闫敏教授牵头的吡咯替尼联合卡培他滨治疗HER2阳性乳腺癌脑转移的研究成果正式全文在线发表于国际权威医学期刊《柳叶刀·肿瘤学》(《Lancet Oncology》,影响因子41.32)。研究结果显示吡咯替尼联合卡培他滨耐受性良好,对颅内、外病灶均能有效抑制,尤其是既往未经治疗的脑转移患者获益明显[1]。

本研究是首个在全部入组人群均为HER2阳性乳腺癌脑转移患者中报道吡咯替尼联合卡培他滨疗效和安全性的前瞻性研究,也是首个在中国患者中根据乳腺癌脑转移既往局部治疗情况,划分为两个独立队列进行分析和比较的前瞻性临床研究,为临床上乳腺癌脑转移治疗和个体化决策带来新的启示。
在曲妥珠单抗为基础治疗的时代,仍有大约30%-50%的人表皮生长因子受体2(HER2)阳性转移性乳腺癌患者会发生脑转移[2-5],导致预后不佳。目前脑转移的治疗以局部治疗手段为主,包括手术切除、立体定向放疗和全脑放疗。然而,局部治疗后6-12月内复发率仍然较高,且会带来认知功能下降等不良反应[6],给临床治疗带来巨大挑战。
PERMEATE研究是一项在全国8家中心开展的多中心、单臂、双队列、Ⅱ期临床研究,旨在研究吡咯替尼联合卡培他滨治疗HER2阳性乳腺癌脑转移的有效性及安全性。PERMEATE研究主要研究者闫敏教授表示:“我国乳腺癌治疗必须依照本国人群疾病发展特征和临床诊疗现状才能指导临床实践。这也是发起我国自主研发创新药吡咯替尼联合卡培他滨治疗HER2阳性乳腺癌脑转移II期临床研究的最重要的意义所在。研究结果提示,对于HER2阳性乳腺癌脑转移,吡咯替尼联合卡培他滨方案对颅内和颅外病灶均能有效控制,尤其是对于既往未接受颅脑局部放疗的患者。吡咯替尼有望成为中国HER2阳性脑转移人群新的治疗方案,同时有望为需要推迟局部治疗的患者提供系统治疗的选择。”
据了解,PERMEATA研究于2019年1月开始,共入组78例有颅内可测量病灶的HER2阳性乳腺癌脑转移患者,其中69例既往接受过曲妥珠单抗的治疗。根据患者中枢神经系统病灶既往局部治疗情况,分为——队列A:未经局部放疗的脑转移患者(N=59);队列B:局部放疗后再次进展的脑转移患者(N=19)。均接受吡咯替尼(400 mg,qd,po)联合卡培他滨(1000mg/m2, bid,po,d1-14,q3w)治疗。主要研究终点为中枢神经系统病灶客观缓解率(CNS ORR)。结果显示队列A的中枢神经系统病灶客观缓解率(CNS ORR)高达74.6%(95%CI:61.6~85.0),其中有7例(11.9%)患者达到完全缓解(CR)。队列B的中枢神经系统病灶客观缓解率(CNS ORR)为42.1%(95%CI:20.3~66.5)。次要终点结果显示,在31例同时伴有颅外可测量病灶的患者中,两个队列非中枢神经系统病灶客观缓解率(Non-CNS ORR)分别为70.4%和50%。中位随访15.7个月,队列A和队列B的中位无疾病进展生存期(PFS)分别为11.3个月(95% CI:7.7~14.6)和5.6个月(95% CI:3.4~10.0)[1]。安全性方面,腹泻和手足综合征是最常见的不良事件,总体可耐受和控制。
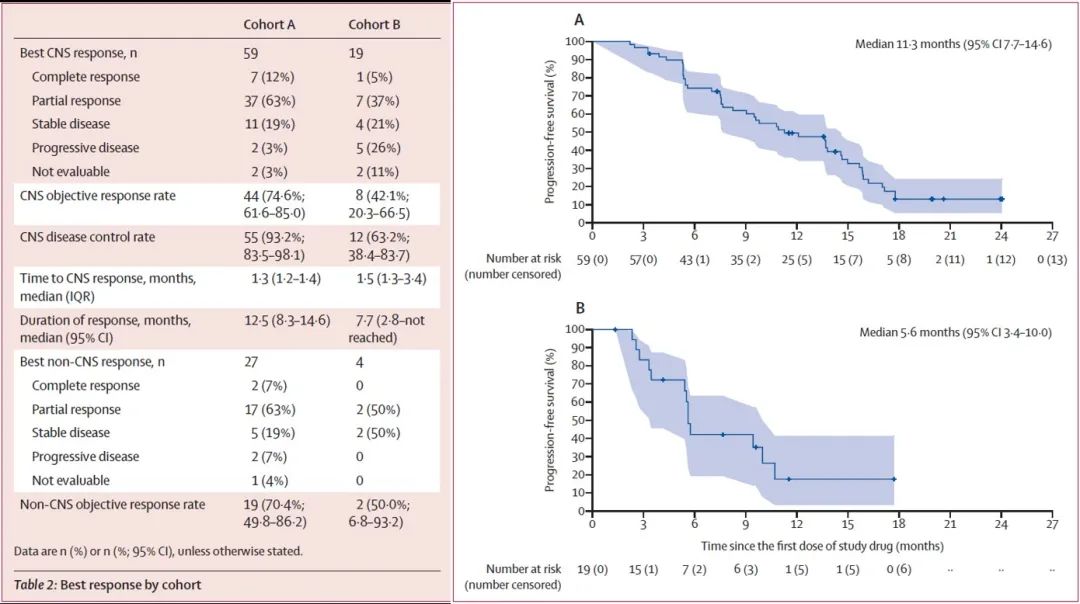
图:主要终点CNS-ORR(队列A 74.6%,队列B 42.1%)和次要终点PFS(队列A 11.3m,队列B 5.6m)结果
PERMEATA研究在2020年欧洲内科肿瘤学会(ESMO)会议和2021年美国临床肿瘤学会(ASCO)年会上获得壁报展示,获得国内外专家的广泛关注。如今,该临床研究成果荣登国际权威学术期刊《柳叶刀·肿瘤学》,展现了国际学界的肯定。
吡咯替尼是恒瑞医药自主研发且具有知识产权的口服表皮生长因子受体(HER1)/人表皮生长因子受体2(HER2)/人表皮生长因子受体4(HER4)酪氨酸激酶抑制剂,是中国首个原研HER1/HER2/HER4靶向药物。2018年,吡咯替尼凭借II期临床研究数据获国家药监局(NMPA)附条件批准上市,是实体瘤领域中国首个凭借II期临床研究获附条件批准上市的创新药。2019年,吡咯替尼被纳入国家医保,大大提升可及性和可负担性。2020年,吡咯替尼凭借两项重要III期研究(PHENIX、PHOEBE)结果获得国家药监局完全批准上市。目前,吡咯替尼还在进行涵盖乳腺癌、肺癌、胆道癌等多个瘤种的多项临床研究,持续探索不同疾病不同阶段的治疗方案,造福更多中国病患。
参考文献:
[1] Yan M, Ouyang Q, Sun T, et al. Pyrotinib plus capecitabine for patients with human epidermal growth factor receptor 2-positive breast cancer and brain metastases (PERMEATE): a multicentre, single-arm, two-cohort,phase 2 trial. Lancet Oncol 2022; published online Jan 24. https://doi.org/10.1016/S1470-2045(21)00716-6
[2] Bendell JC, Domchek SM, Burstein HJ, et al. Central nervous system metastases in women who receive trastuzumab-based therapy for metastatic breast carcinoma. Cancer. 2003. 97(12): 2972-7
[3] Gori S, Rimondini S, De Angelis V, et al. Central nervous system metastases in HER-2 positive metastatic breast cancer patients treated with trastuzumab: incidence, survival, and risk factors. Oncologist. 2007. 12(7): 766-73
[4] Brufsky AM, Mayer M, Rugo HS, et al. Central nervous system metastases in patients with HER2-positive metastatic breast cancer: incidence, treatment, and survival in patients from registHER. Clin Cancer Res. 2011. 17(14): 4834-43
[5] Olson EM, Najita JS, Sohl J, et al. Clinical outcomes and treatment practice patterns of patients with HER2-positive metastatic breast cancer in the post-trastuzumab era. Breast. 2013. 22(4): 525-31
[6] Tanguturi S, Warren L. The Current and Evolving Role of Radiation Therapy for Central Nervous System Metastases from Breast Cancer. Curr Oncol Rep. 2019. 21(6): 50






