【协和医学杂志】心肌血流灌注SPECT新技术进展及其临床价值
冠状动脉疾病是全球第三大致死性疾病,每年导致近1780万人死亡[1]。据《2022中国卫生健康统计年鉴》[2]和《中国心血管病报告2022》[3]显示,心血管病是我国居民的首要死亡原因。其中,以冠状动脉粥样硬化为主要病因的缺血性心脏病最为常见。心肌血流灌注成像(MPI)是针对冠状动脉疾病最常用的非侵入性诊断方法之一。通过MPI可识别冠状动脉异常区域,确定影响心肌功能的病理性原因。 单光子发射计算
冠状动脉疾病是全球第三大致死性疾病,每年导致近1780万人死亡[1]。据《2022中国卫生健康统计年鉴》[2]和《中国心血管病报告2022》[3]显示,心血管病是我国居民的首要死亡原因。其中,以冠状动脉粥样硬化为主要病因的缺血性心脏病最为常见。心肌血流灌注成像(MPI)是针对冠状动脉疾病最常用的非侵入性诊断方法之一。通过MPI可识别冠状动脉异常区域,确定影响心肌功能的病理性原因。
单光子发射计算机断层显像(SPECT)是MPI最常用的显像技术[4],在冠状动脉疾病诊断和风险分级中应用广泛。从成像系统原理的角度看,SPECT显像的关键技术包括:
(1)探测器技术,即捕获人体中核素衰变发出伽马光子,并测量光子事件的位置、能量、方向信息;(2)准直技术,即判别到达探测器的光子方向;(3)重建算法技术,即从特定采集时间内接受到的大量光子事件信息,经数学算法重建得到体内的药物空间和时间分布信息;(4)通过图像处理、定量化和数据分析方法与临床实践进一步结合,提供临床诊断所需的依据。
传统的可变角双探头SPECT通常采用平行孔准直器和基于连续掺铊碘化钠[thallium-doped sodium iodide, NaI(Tl)]晶体和光电倍增管阵列的Anger相机作为探测器。系统典型空间分辨率为10~20 mm,探测效率为0.01%~0.02%。
近年来,针对心脏成像的专用SPECT系统快速发展,引入了多针孔准直器技术和半导体碲锌镉(CZT)探测器技术,极大提高了空间分辨率和探测效率。在图像算法方面,基于统计迭代重建框架的算法技术不断发展,并结合定量化方法,显著提高了SPECT MPI的图像质量和诊断精度。
随着核医学影像仪器和技术的不断进步,SPECT MPI在心血管疾病诊疗中的应用不断拓展。对于临床医生而言,理解SPECT技术的最新进展及其对于临床的支持价值具有重要意义。本文旨在综述近年来心脏专用SPECT系统及技术研究进展,并介绍其在MPI临床诊疗中的应用价值。
1心脏专用SPECT系统
1.1 新型探测器技术
SPECT自20世纪50年代问世以来,一直采用Anger发明的伽马相机结构,即整块连续NaI(Tl)晶体耦合光电倍增管(PMT)阵列,使伽马光子入射在NaI(Tl)晶体上产生的闪烁光子分布入射至多个PMT上,利用权重定位算法获取光子的位置信息。Anger相机的固有空间分辨率受限于闪烁晶体的发光量、闪烁光子在PMT上的接受比例、电子学噪声等因素,典型值为3.5~4 mm。
近年来,半导体CZT探测器技术[5-8]引入核医学影像仪器,推动了SPECT/CT系统的发展。与传统Anger相机不同,CZT探测器采用逐像素读出信号的方式,其固有空间分辨率取决于像素切割尺寸,因此可达2~3 mm。CZT探测器将入射的高能伽马光子直接转换为可探测的电信号,因此其能量分辨率可达3%~6%@140 keV,显著优于NaI(Tl)闪烁晶体探测器(能量分辨率一般为~9.5%@140 keV)。
能量分辨率的提升可有效减少人体内散射光子对成像的影响,提高图像定量精度。但CZT探测器的材料制备工艺、电接触工艺复杂,多通道读出电子学技术门槛高,探测器成本远高于NaI(Tl)闪烁晶体探测器。
1.2 准直技术与系统性能
SPECT系统的空间分辨率和探测效率性能由准直器和探测器综合决定。对传统可变角双探头人体SPECT,其系统空间分辨率综合取决于准直器的几何空间分辨率和探测器的固有空间分辨率,其中准直器的几何模糊效应占主导,是SPECT系统低空间分辨率的主要因素。
SPECT系统探测效率是准直器的光子通过比例与探测器的光子捕获比例之乘积,通常准直器的光子通过比例不足千分之一,是SPECT系统低探测效率的主要因素。如果通过扩大准直器孔径等方式提升探测效率,系统空间分辨率将进一步下降。
心脏专用SPECT系统通过专门的多针孔等准直器将视野聚焦于心脏区域、选用高分辨率的半导体探测器并采用围绕心脏区域的多探头几何结构等手段,使心脏视野区域的成像性能显著提升。
典型的心脏专用SPECT系统与技术包括IQ·SPECT技术,其在临床SPECT上搭载专用于心脏成像的聚焦准直器,使得成像视野集中于心脏区域,有效提升心肌区域的探测计数[9-11]。
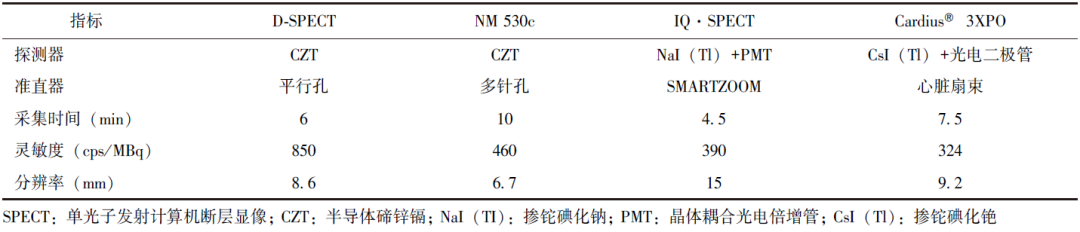
另一类典型的心脏专用SPECT系统为NM 530C[8](SPECT) 和NM 570C (SPECT/CT)。该系统由19个探头(8 cm × 8 cm)构成,每个探头由4个CZT探测器和1个针孔准直器构成。其中CZT探测器保证了良好的固有空间分辨率;所有探头均聚焦于心脏区域,从而提高了心脏区域的探测效率;在数据采集过程中所有探头均静止,从而提高了成像的帧率。该系统能够达到6.7 mm空间分辨率和0.046% 平均探测效率[12-13]。
值得注意的是,由于该系统采用针孔准直器,其视野中不同位置的分辨率和探测效率差异相对明显(分辨率为5~10 mm,探测效率为0.020%~0.091%),因此患者体位对图像质量的影响相对较大[14]。
再如小视野、高分辨率/高探测效率D-SPECT。该系统基于高固有空间分辨率的CZT探测器和平行孔准直器开发[15]。该系统由9个探头(4 cm×16 cm)构成,每个探头由4个CZT探测器和1个平行孔准直器构成。其中CZT探测器(4 cm×4 cm)的固有分辨率为2.5 mm;相较于典型平行孔准直器,该系统的准直器采用钨材料制造,准直孔与探测器单元一对一耦合设计,减少了伽马光子穿透,提高了对高频信号的恢复效果;同时,准直器厚度更小(21.7 mm)、孔径更大(2.26 mm),因而能够允许更多光子穿过准直器,从而提高了探测效率。
在数据采集过程中,每个探头均围绕各自中轴独立旋转,并通过将视野聚焦于心脏区域进一步提高了感兴趣区域的成像性能。该系统能够达到8.6 mm的平均空间分辨率和0.085%的平均探测效率[12-13]。
此外,还有一些心肌成像系统尝试了创新的系统构造,例如Cardius®3XPO系统采用三探头结构,可围绕心脏位置进行转动,尽可能减少探头与患者心脏的距离,提升成像质量[16]。该系统还配备了座椅结构,提升了患者在进行数据采集过程中的舒适度。
除上述已经投入商用的心肌成像系统外,还有一些尚未商业化的新型心肌SPECT系统正处于研发中,例如具有C型环状结构的C-SPECT,多针孔双探头心肌SPECT等[17-22]。
表1总结了典型心脏专用SPECT系统和传统双探头SPECT系统的性能指标,数据显示,大多数心脏专用SPECT系统的灵敏度为0.03%~0.10%,在4.5~10 min采集时间下的成像分辨率为6~10 mm[9,12-14,23]。
表1典型心脏专用SPECT系统特性对比
1.3 自准直成像技术
心脏专用SPECT的准直器技术、系统几何结构变化和新探测器技术的引入使成像性能和图像质量显著提升。然而,SPECT机械准直器需吸收掉绝大部分光子以换取极少数光子的方向信息,准直器设计不能兼顾空间分辨率和探测效率,造成二者相互制约,难以提升,这也是SPECT图像质量显著差于PET和其他临床影像技术的瓶颈因素。
我国学者提出了 “用探测器做准直器”的自准直SPECT成像原始创新思想[24]。在自准直SPECT中,通过将SPECT探测器构造为三维空间稀疏分布的探测器单元阵列,使光子通过在某些探测器单元上的吸收,自然形成对其他探测器单元的准直效应;同时,被任一探测器单元接收的光子均未损失,共同对成像过程产生贡献,从本质上不再需要损失大量光子来换取对其他光子的定向效果。因此,“自准直”思想从成像机理上解决了机械吸收准直造成的SPECT空间分辨率和探测效率相互制约瓶颈,使二者具备同时提升的可能[25]。
现有研究初步表明,设计专用于心脏自准直SPECT(图 1),在心脏成像视野中达到4 mm空间分辨率和0.68%探测效率,并有望在数秒内完成MPI[26]。
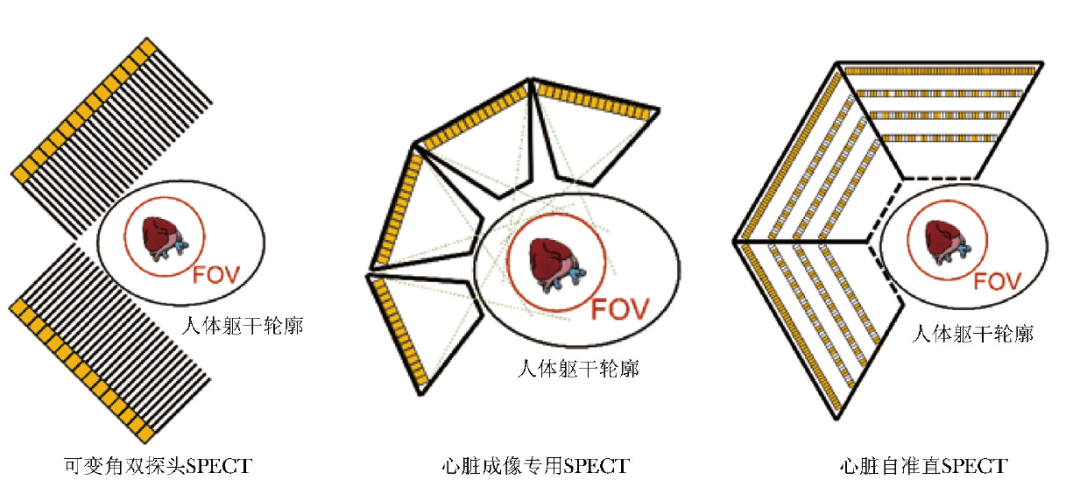
图1心脏成像SPECT系统
SPECT:同表1
自准直SPECT相关研究在突破准直器技术瓶颈的前提下,未来有望使SPECT性能大幅提高,有效提升SPECT的临床应用价值并带来创新的SPECT分子影像应用。
2SPECT图像重建与心肌血流定量化技术
2.1 图像重建算法技术
早期的SPECT成像采用了滤波反投影等解析重建方法。然而,目前临床上更广泛接受的是基于统计估计的迭代重建方法,如极大似然-期望最大化(ML-EM)算法和有序子集-期望最大化(OS-EM)算法。这些统计估计类算法能够充分考虑SPECT测量数据的噪声特性,并有效抑制由统计涨落引起的图像噪声。
此外,迭代算法还可对成像过程中的几何和物理因素进行有效建模并推动SPECT图像向定量方向发展,包括准直器响应几何特性、人体组织对光子的衰减和散射效应校正、部分容积效应校正和归一化因子刻度技术。
成像过程中患者的呼吸运动和心脏运动通常会导致重建图像出现运动模糊或伪影。虽然门控重建可有效阻止图像质量下降,但其分帧重建则会显著减少用于重建每帧图像的投影计数并使得图像噪声增加。而使用门控信息直接联合重建的新型4D图像重建算法[27]可在图像噪声较低的条件下有效减少图像运动模糊,因而能够提高定量重建精度。
目前尽管SPECT的空间分辨率和探测效率相对较低,给高精度定量成像带来了挑战,但近年来,随着定量化相关技术的不断进步[28],现代SPECT设备多已配置定量化软件模块[29-30],并逐步应用于临床实践[31]。
一项多中心研究表明,不同厂家和机型之间的SPECT定量结果受不同厂家算法和设备参数设置的影响,采用统一的第三方算法和定量化软件可进一步改善定量结果之间的差异[32]。有研究表明,患者的身体尺寸对定量精度影响亦较显著[33]。
2.2 心肌血流定量技术
心肌血流定量的典型原理和步骤如图2所示。
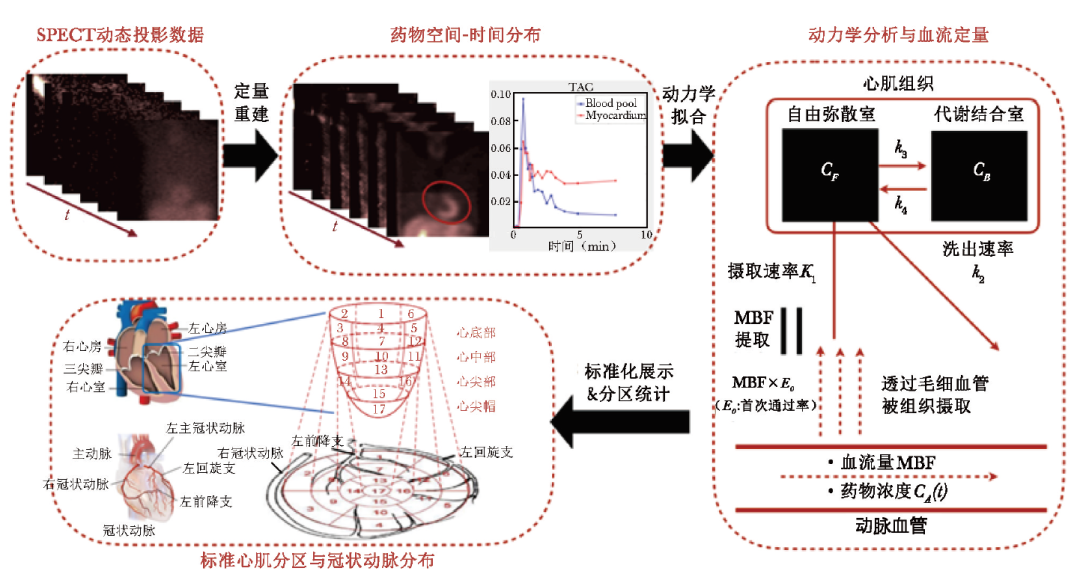
图2心肌血流定量的典型原理和步骤
SPECT:同表1;MBF:心肌血流量
以SPECT 甲氧基异丁基异腈(MIBI)显像为例,进行定量显像的典型步骤包括:
(1)在多个时间点上采集静息和负荷三维SPECT图像并进行定量化;
(2)计算血浆输入函数曲线与心肌时间活度曲线;
(3) 根据一房室模型求解药物穿过毛细血管和细胞膜的正向速率K1;
(4)根据Renkin-Crone模型分别求解静息/负荷状态下的心肌血流量(MBF)并相应计算心肌血流储备(MFR)[34]。
目前SPECT的血流定量精度主要受两个因素的影响:
首先,MIBI药物摄取量与MBF间的线性关系与15O-水 PET显像和13N-氨水 PET显像相比而言较差;
其次,SPECT的分辨率和探测效率均低于PET(图像分辨率典型值为4.5~6 mm,探测效率典型值为0.73%)[35],受图像噪声和部分容积效应等因素影响,基于SPECT的血流定量成像精度相对更低。
但由于MPI的PET示踪剂需使用加速器制备,药物半衰期短(如15O为2 min、13N为10 min),在不具备加速器制药条件的研究和临床单位无法开展,因而SPECT仍是临床MPI的主要技术。
此外,定量成像需在多时间点快速SPECT断层扫描,且计算过程复杂,定量精度和一致性易受图像噪声影响。近年来,心脏专用SPECT的性能提升使得MPI扫描时间已缩短至2~5 min[8,15],并能够使得SPECT心脏动态成像技术和MBF/MFR定量在临床上得以实现[24,36-37]。近年来大量研究工作对比评价了CZT SPECT和目前作为MPI金标准的PET成像技术。
多项研究认可CZT SPECT血流定量的临床价值[38-40],但其定量价值目前仍存在争议。如D'Antonio等[41]指出, D-SPECT与NM530C提供的MBF和MFR值存在差异,原因可能是空间分辨率存在差异,因而部分容积效应导致了定量精度变化;Giubbini等[40]对比N13NH3-PET 和99mTc-Tetrofosmin-CZT SPECT的MBF定量结果,认为二者虽有相关性,但CZT SPECT的定量精度仍不理想,不足以替代PET;de Souza等[42]指出,尽管半导体探测器SPECT的空间分辨率和探测效率高于传统NaI SPECT,但与PET相比仍有劣势;同时,人体运动模糊效应也引入了CZT SPECT定量评估结果的不确定性,其目前仍不足以取代PET。
3心肌血流定量的临床应用
3.1 冠心病诊断
与传统定性和半定量评估方法相比,基于MPI的MBF/MFR(评估冠状动脉的功能学和生理学指标)定量评估有助于检测均衡性多血管疾病(所有血管均狭窄),该疾病可导致整体血流量减少并常在定性MPI SPECT诊断中为假阴性;还可在心肌缺血早期、心肌微血管病变、心肌纤维化和心肌代谢紊乱等情况下进行有效的分子标志物检测;此外,其还可用于评估冠状动脉介入治疗的疗效,预测患者的心血管事件风险和死亡率等,在心肌缺血评估和患者预后管理中的价值已受到明确认可[4,43]。
3.2 冠状动脉微循环功能评估
冠状动脉 90%以上的血管是直径小于 500 μm的微血管,近年来冠状动脉微血管功能障碍(CMD)受到越来越多的关注,相关研究表明CMD在冠心病发病中起重要作用[44-45]。如ISCHEMIA研究比较了药物和有创方法疗效的 4 项临床试验结果发现,对中度或重度缺血的稳定型冠心病患者,初始有创治疗策略在中位3.2年期间未降低缺血性心血管事件或全因死亡风险,与初始保守治疗策略相比无明显差异[46]。
对CMD发病机制的深入研究,主要包括微循环再灌注损伤、内皮细胞功能异常、神经调控异常、炎症反应和代谢紊乱等,能够为诊断和治疗提供更准确的依据[45,47-48],是未来降低心血管疾病发病率和死亡率的迫切需求。冠状动脉微血管在常规冠状动脉造影中不可见,SPECT MPI可有效评估心肌血流和心脏功能,帮助临床确定治疗方案。
4小结与展望
本文从SPECT系统、算法技术及定量化方法方面,简要阐述了MPI SPECT技术的研究进展。近年来,心脏专用CZT SPECT成像系统为MPI显像提供了有力技术支撑,然而其定量精度能否达到金标准PET水平仍无定论,更优的探测技术和准直技术仍有待进一步研发。
多方面的物理校正和图像校正方法已趋于完备,其中多种新型校正方法的临床有效性有待长期验证。针对心肌血流定量的相关技术研究和临床应用评估是目前的研究热点,未来仍需医学科学家、物理技术科学家、工程师进行长期、密切的交流合作,依托医工结合模式使创新技术更好地为临床应用服务。
参考文献
[1]Brown JC, Gerhardt TE, Kwon E. Risk Factors For Coronary Artery Disease[M]. Treasure Island (FL):StatPearls,2022.
[2]中华人民共和国国家卫生健康委员会. 2022中国卫生健康统计年鉴[EB/OL].(2023-05-17)[2023-06-30]. http://www.nhc.gov.cn/mohwsbwstjxxzx/tjtjnj/202305/6ef68aac6bd14c1eb9375e01a0faa1fb.shtml.
[3]国家心血管病中心.中国心血管病报告2022[M/OL].(2022)[2023-06-30]. https://www.nccd.org.cn/News/Information/Index/1089.
[4]Dewey M, Siebes M, Kachelrieβ M, et al. Clinical quantitative cardiac imaging for the assessment of myocardial ischaemia[J]. Nat Rev Cardiol, 2020, 17: 427-450.
[5]Dorbala S, Ananthasubramaniam K, Armstrong IS, et al. Single Photon Emission Computed Tomography (SPECT) Myocardial Perfusion Imaging Guidelines: Instrumentation, Acquisition, Processing, and Interpretation[J]. J Nucl Cardiol, 2018, 25: 1784-1846.
[6]Erlandsson K, Kacperski K, van Gramberg D, et al. Performance evaluation of D-SPECT: a novel SPECT system for nuclear cardiology[J]. Phys Med Biol, 2009, 54: 2635-2649.
[7]Hutton BF, Erlandsson K, Thielemans K. Advances in clinical molecular imaging instrumentation[J]. Clin Transl Imaging, 2018, 6: 31-45.
[8]Bocher M, Blevis IM, Tsukerman L, et al. A fast cardiac gamma camera with dynamic SPECT capabilities: design, system validation and future potential[J]. Eur J Nucl Med Mol Imaging, 2010, 37: 1887-1902.
[9]Slomka PJ, Berman DS, Germano G. New Cardiac Cameras: Single-Photon Emission CT and PET[J]. Semin Nucl Med, 2014, 44: 232-251.
[10]Nakajima K, Okuda K, Momose M, et al. IQ·SPECT technology and its clinical applications using multicenter normal databases[J]. Ann Nucl Med, 2017, 31: 649-659.
[11]Vija AH, Malmin R, Yahil A, et al. A method for improving the efficiency of myocardial perfusion imaging using conventional SPECT and SPECT/CT imaging systems[C]. IEEE Nuclear Science Symposuim & Medical Imaging Conference, 2010.
[12]Imbert L, Poussier S, Franken PR, et al. Compared Performance of High-Sensitivity Cameras Dedicated to Myocardial Perfusion SPECT: A Comprehensive Analysis of Phantom and Human Images[J]. J Nucl Med, 2012, 53: 1897.
[13]Chaudhari AJ, Badawi RD. Application-specific nuclear medical in vivo imaging devices[J]. Phys Med Biol, 2021, 66: 10TR01.
[14]Wu J, Liu C. Recent advances in cardiac SPECT instrumentation and imaging methods[J]. Phys Med Biol, 2019, 64: 06TR01.
[15]Gambhir SS, Berman DS, Ziffer J, et al. A Novel High-Sensitivity Rapid-Acquisition Single-Photon Cardiac Imaging Camera[J]. J Nucl Med, 2009, 50: 635-643.
[16]DePuey EG. Advances in SPECT camera software and hardware: Currently available and new on the horizon[J]. J Nucl Cardiol, 2012, 19: 551-581.
[17]Mao Y, Yu Z, Zeng GL. Segmented slant hole collimator for stationary cardiac SPECT: Monte Carlo simulations[J]. Med Phys, 2015, 42: 5426-5434.
[18]Hui L, Jing W, Si C, et al. Development of stationary dedicated cardiac SPECT with multi-pinhole collimators on a clinical scanner[C]. 2015 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC), 2015.
[19]Ogawa K, Ichimura Y. Simulation study on a stationary data acquisition SPECT system with multi-pinhole collimators attached to a triple-head gamma camera system[J]. Ann Nucl Med, 2014, 28: 716-724.
[20]Bowen JD, Huang Q, Ellin JR, et al. Design and performance evaluation of a 20-aperture multipinhole collimator for myocardial perfusion imaging applications[J]. Phys Med Biol, 2013, 58: 7209-7226.
[21]Chang W, Ordonez CE, Liang H, et al. C-SPECT—A Clinical Cardiac SPECT/Tct Platform: Design Concepts and Performance Potential[J]. IEEE Trans Nucl Sci, 2009, 56: 2659-2671.
[22]Kalluri K, Bhusal N, Shumilov D, et al. Multi-pinhole cardiac SPECT performance with hemi-ellipsoid detectors for two geometries[C]. 2015 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC), 2015.
[23]Patton JA, Slomka PJ, Germano G, et al. Recent technologic advances in nuclear cardiology[J]. J Nucl Cardiol, 2007, 14: 501-513.
[24]Acampa W, Zampella E, Assante R, et al. Quantification of myocardial perfusion reserve by CZT-SPECT: A head to head comparison with 82Rubidium PET imaging[J]. J Nucl Cardiol, 2021, 28: 2827-2839.
[25]Zhang D, Lyu Z, Liu Y, et al. Characterization and assessment of projection probability density function and enhanced sampling in self-collimation SPECT[J]. IEEE Trans Med Imaging, 2023.doi: 10.1109/TMI.2023.3265874.
[26]Zhang D, Zheng X, Hu Y, et al. Feasibility study of a self-collimating SPECT for fast dynamic cardiac imaging[J]. J Nucl Med, 2022, 63: 2338.
[27]Qi W, Yang Y, Song C, et al. 4-D Reconstruction With Respiratory Correction for Gated Myocardial Perfusion SPECT[J]. IEEE Trans Med Imaging, 2017, 36: 1626-1635.
[28]Dickson J, Ross J, Vöö S. Quantitative SPECT: the time is now[J]. EJNMMI Phys, 2019, 6: 4.
[29]Miyaji N, Miwa K, Tokiwa A, et al. Phantom and clinical evaluation of bone SPECT/CT image reconstruction with xSPECT algorithm[J]. EJNMMI Res, 2020, 10: 71.
[30]D'Ambrosio L, Aloj L, Chiaramida P, et al. Quantitative SPECT/CT imaging using a commercial software[J]. Phys Med: Eur J Med Phys, 2016, 32: 102-103.
[31]Dickson JC, Armstrong IS, Gabiña PM, et al. EANM practice guideline for quantitative SPECT-CT[J]. Eur J Nucl Med Mol Imaging, 2023, 50: 980-995.
[32]Peters SM, van der Werf NR, Segbers M, et al. Towards standardization of absolute SPECT/CT quantification: a multi-center and multi-vendor phantom study[J]. EJNMMI Phys, 2019, 6: 29.
[33]Fukai S, Daisaki H, Umeda T, et al. Impact of patient body habitus on image quality and quantitative value in bone SPECT/CT[J]. Ann Nucl Med, 2022, 36: 586-595.
[34]Hsu B, Hu LH, Yang BH, et al. SPECT myocardial blood flow quantitation toward clinical use: a comparative study with (13)N-Ammonia PET myocardial blood flow quantitation[J]. Eur J Nucl Med Mol Imaging, 2017, 44: 117-128.
[35]Michopoulou S, O'Shaughnessy E, Thomson K, et al. Discovery Molecular Imaging Digital Ready PET/CT perfor-mance evaluation according to the NEMA NU2-2012 standard[J]. Nucl Med Commun, 2019, 40: 270-277.
[36]Nudi F, Biondi-Zoccai G, Nudi A, et al. Comparative analysis between myocardial perfusion reserve and maximal ischemia score at single photon emission computed tomography with new-generation cadmium-zinc-telluride cameras[J]. J Nucl Cardiol, 2021, 28: 1072-1084.
[37]Shiraishi S, Tsuda N, Sakamoto F, et al. Clinical usefulness of quantification of myocardial blood flow and flow reserve using CZT-SPECT for detecting coronary artery disease in patients with normal stress perfusion imaging[J]. J Cardiol, 2020, 75: 400-409.
[38]Nudi F, Biondi-Zoccai G, Nudi A, et al. Comparative analysis between myocardial perfusion reserve and maximal ischemia score at single photon emission computed tomography with new-generation cadmium-zinc-telluride cameras[J]. J Nucl Cardiol, 2021, 28: 1072-1084.
[39]Fang W, Hsu B. Myocardial blood flow quantitation with the SPECT technique: Is it ready to be a substitute for PET myocardial blood flow quantitation?[J]. J Nucl Cardiol, 2022, 29: 3152-3154.
[40]Giubbini R, Bertoli M, Durmo R, et al. Comparison between N13NH3-PET and99mTc-Tetrofosmin-CZT SPECT in the evaluation of absolute myocardial blood flow and flow reserve[J]. J Nucl Cardiol, 2021, 28: 1906-1918.
[41]D'Antonio A, Assante R, Zampella E, et al. Myocardial blood flow evaluation with dynamic cadmium-zinc-telluride single-photon emission computed tomography: Bright and dark sides[J]. Diagn Interv Imaging, 2023,104:323-329.
[42]de Souza ACDAH, Harms HJ, Martell L, et al. Accuracy and Reproducibility of Myocardial Blood Flow Quantification by Single Photon Emission Computed Tomography Imaging in Patients With Known or Suspected Coronary Artery Disease[J]. Circ Cardiovasc Imaging, 2022, 15: e013987.
[43]Knott KD, Seraphim A, Augusto JB, et al. The Prognostic Significance of Quantitative Myocardial Perfusion[J]. Circulation, 2020, 141: 1282-1291.
[44]Camici PG, d'Amati G, Rimoldi O. Coronary microvascular dysfunction: mechanisms and functional assessment[J]. Nat Rev Cardiol, 2015, 12: 48-62.
[45]Taqueti VR, Di Carli MF. Coronary Microvascular Disease Pathogenic Mechanisms and Therapeutic Options: JACC State-of-the-Art Review[J]. J Am Coll Cardiol, 2018, 72: 2625-2641.
[46]Maron DJ, Hochman JS, Reynolds HR, et al. Initial Invasive or Conservative Strategy for Stable Coronary Disease[J]. N Engl J Med, 2020, 382: 1395-1407.
[47]Ford Thomas J, Ong P, Sechtem U, et al. Assessment of Vascular Dysfunction in Patients Without Obstructive Coronary Artery Disease[J]. JACC Cardiovasc Interv, 2020, 13: 1847-1864.
[48]Del Buono Marco G, Montone Rocco A, Camilli M, et al. Coronary Microvascular Dysfunction Across the Spectrum of Cardiovascular Diseases[J]. J Am Coll Cardiol, 2021, 78: 1352-1371.






