胃癌是目前全球第五大常见癌症,其病死率排名第四。中国是胃癌高发国家,据2020年中国最新数据统计,胃癌发病率和死亡率在各种恶性肿瘤中均位居第三。手术切除以及结合放化疗、靶向和免疫治疗的多学科诊疗是目前胃癌治疗的主要方法。
随着精准医学的发展,癌症的分子靶向治疗已成为胃癌的主要治疗方法。人表皮生长因子受体2(HER2)是人表皮生长因子受体家族的一员,在调节正常细胞生长、肿瘤细胞的增殖和转移中起关键作用。在胃癌中,HER-2表达也被认为是影响患者预后的独立性危险因素。
2023年6月11日第13届北京消化肿瘤国际高峰论坛暨中国胃肠肿瘤临床研究协作组(CGOG)年会于北京盛大召开。在胃癌分会场,中国科学技术大学附属第一医院何义富教授分享了题为“探索与优化HER2高表达胃癌的治疗”的学术报告。本次Oncology论坛整理了相关内容,以飨读者。

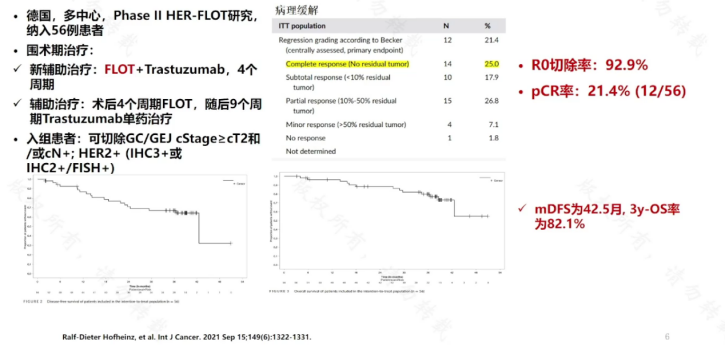
德国一项多中心的Ⅱ期研究(HER-FLOT研究),共纳入56例患者,新辅助治疗采用4周期的FLOT联合曲妥珠单抗治疗方案,在辅助治疗阶段,术后进行4个周期的FLOT(氟尿嘧啶、亚叶酸、奥沙利铂、多西紫杉醇)治疗,随后9个周期采用曲妥珠单抗单药治疗。结果表明,病理完全缓解率(pCR)可达21.4%,肿瘤完整切除(R0)率为92.9%,中位无病生存期(mDFS)为42.5个月,3年总生存率(OS)为82.1%。
西方侧重于三药联合治疗HER2阳性胃癌患者,但东方研究者更倾向于两药联合方案。日本的一项随机Ⅱ期研究(Trigger研究),共纳入46例伴广发淋巴结转移的胃癌患者,随机给予S1联合顺铂或曲妥珠单抗治疗。
结果表明,在HER2阳性胃癌患者中,采用S-1联合曲妥珠单抗进行术前化疗可获得更好的客观反应率,并有望获得更好的生存结果。但次此试验中,pCR率只有4%,可能与胃癌分期有关。
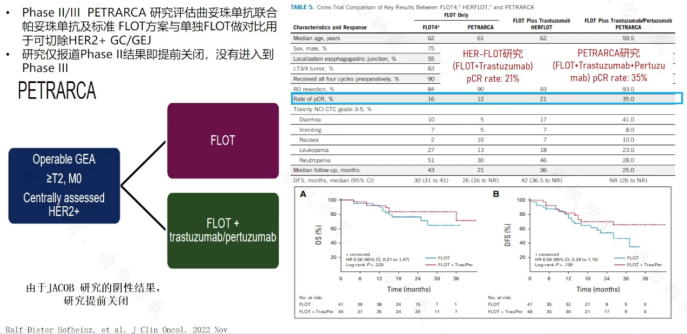
Ⅱ/Ⅲ期PETRARCA研究评估了曲妥珠单抗联合帕妥珠单抗及标准FLOT方案与FLOT方案疗效,联合方案的pCR率可达35%。但由于该研究样本量较少,结果为阴性,因此研究仅报道Ⅱ期结果即提前关闭,未进入Ⅲ期研究。
现有的结果表明,“妥妥”联合FLOT方案似乎更好。但在今年ASCO年会一项最新的研究中,研究目的是通过在HER2阳性可切除的胃癌和食管胃结合部癌围手术期化疗中单独加入曲妥珠单抗或曲妥珠单抗联合帕妥珠单抗,以期提高新辅助治疗的主要病理反应率。
研究表明,以FLOT为主要化疗方案显示出有前景的主要病理反应率,但进一步添加帕妥珠单抗并未增加疗效,反而增加了不良反应。与乳腺癌不同的是,曲妥珠单抗联合帕妥珠单抗起到协同增效的作用,胃癌中却铩羽而归,这可能是由于胃癌异质性强、耐受性弱等原因造成的。
如何在围手术期间平衡疗效与安全性,结合之前的探索,能否在曲妥珠单抗+化疗的基础上联合免疫治疗是值得探讨的。一项单臂、单中心的Ⅱ期研究对其疗效和安全性进行了评估,结果表明,pCR达到了31.3%。目前,免疫联合靶向在可切除HER2阳性胃癌围手术期的研究正在如火如荼开展,部分结果已揭示,未来期待更多数据发表,为该方案提供的实施提供证据。
KN026-202是一项单臂、开放标签、多中心的Ⅱ期临床研究,旨在评估KN026单药用于经治的晚期HER2表达的胃癌患者的疗效和安全性。
Ⅱ期结果显示,ORR达56%,需要有更进一步的临床试验获得更多数据。KN026(靶向HER-2双抗)联合KN046(抗PD-L1/CTLA-4双抗)前期结果表明,客观缓解率(ORR)高达71.4%,疾病控制率(DCR)为92.6%,一线免疫治疗显示出有效的治疗前景。
今年ASCO报道的INTEGA研究中的两组方案,一组为去化疗方案曲妥珠单抗+纳武利尤单抗+Ipilimumab,另一组是化疗方案曲妥珠单抗+纳武利尤单抗+FOLFOX。
随着随访时间的增加(中位随访时间为18.8个月),化疗组的中位OS为21.8个月,而去化疗组为23.2个月,疗效较好。
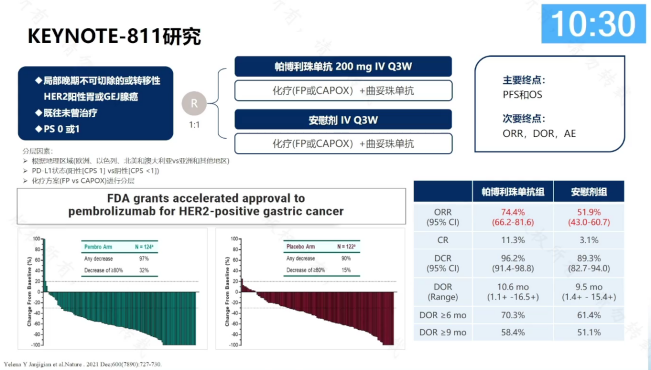
KEYNOTE-811研究是一项随机、双盲、安慰剂对照的III期研究,旨在评估帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER-2阳性不可切除或转移性胃癌/胃食管交界处腺癌的疗效和安全性。
结果显示,ORR提升至74.4%。基于该研究结果,2021年5月,美国食品药品监督管理局(FDA)加速批准帕博利珠单抗联合曲妥珠单抗和化疗用于HER-2阳性晚期胃癌的一线治疗。
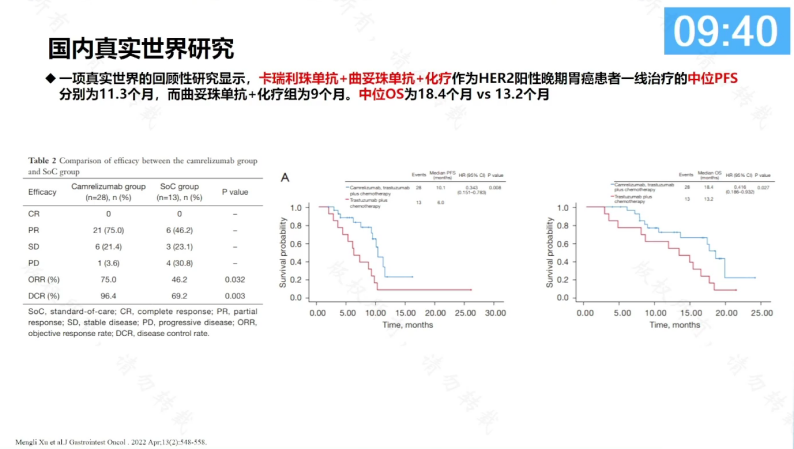
国内一项真实世界的回顾性研究显示,卡瑞利珠单抗+曲妥珠单抗+化疗作为HER2阳性晚期胃癌患者一线治疗的中位PFS为11.3个月,而曲妥珠单抗+化疗组为9个月,中位OS为18.4个月 vs 13.2个月。
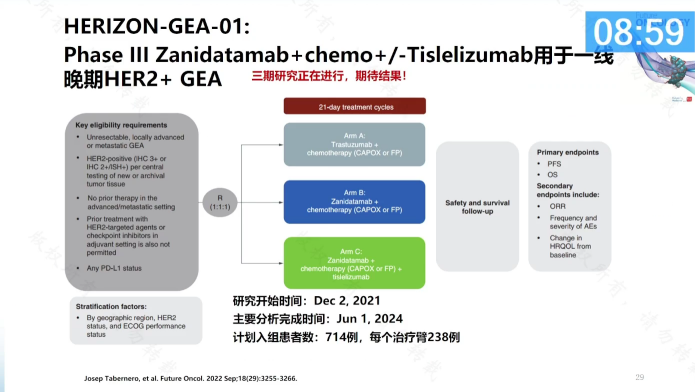
2018年ESMO首次报道了Zanidatamab治疗HER2+胃癌患者的疗效,今年ASCO更新了入组信息,中位随访时间为21.5个月,ORR高达79%。基于此,Zanidatamab正在开展全球的Ⅲ期法研究(HERIZON-GEA-01)。该研究的中国leading PI是沈琳教授,期待其最终的结果。
对于KEYNOTE-811等研究的成功,何教授认为主要是基于以下几点:
-
胃癌中HER2的表达与免疫治疗相关基因的表达水平相关,HER2高表达的肿瘤与CTLA-4、LAG-3、CD274、PDCD1、TIGIT和PDCD1LG2的表达显著降低相关
-
在HER2阳性胃癌耗竭T细胞的评分显著高于HER2阴性胃癌,揭示HER2阳性肿瘤具有相对活跃的免疫微环境
-
化疗药物治疗可以增加肿瘤抗原,改善冷肿瘤的状态,与免疫检查点抑制剂具有良好的协同作用
新一代ADC药物具有双重抗肿瘤机制。ADC药物的作用机制是通过具有高内吞活性的抗体靶向识别,将毒素分子带入肿瘤细胞内,再利用毒素分子特异性杀伤肿瘤细胞。同时ADC药物一般采用可裂解的连接子,在胞内更高效的释放毒的同时也可以通过旁观者效应实现对临近肿瘤细胞的杀伤,增强ADC药物的治疗效果。
新一代ADC药物结构全面优化,临床疗效获得提升。DESTINY GASTRIC01是一项随机的临床Ⅱ期研究,T-DXd(DS-8201)用于接受两线或多线治疗后出现疾病进展的HER2+胃癌患者,ORR达51.3%,mOS为12.5个月。
国产药物RC48用于三线及以上HER2+胃癌患者的Ⅱ期研究表明,ORR达24.8%。基于RC48研究结果,2023年CSCO更新了HER2+胃癌的三线靶向治疗方案,将维迪西妥单抗由Ⅱ级推荐前移至Ⅰ级推荐。
ADC药物如何向前线推荐,如何使用联合方案,是值得探索的。ADC药物从后线向一线、二线推进时,可供选择的方案较多,但向前线推进时是否存在合适的marker是至关重要的。
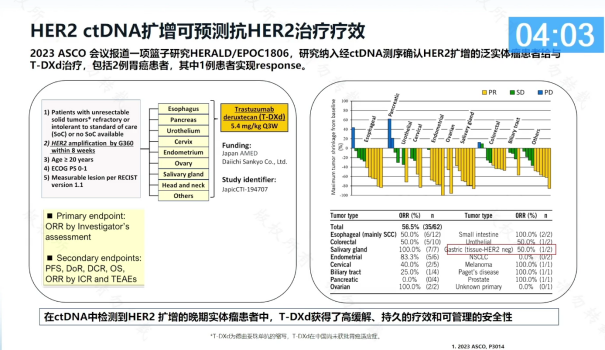
今年ASCO会议报道了一项篮子研究HERALD/EPOC1806,研究纳入了经ctDNA测序确认HER2扩增的泛实体瘤患者给予T-DXd治疗,其中包括2例胃癌患者,1例患者实现缓解。
随着HER2阳性胃癌患者治疗药物不断涌现,HER2阳性胃癌患者治疗方案也将不断更新。同类药物由于机制轻微差异, 临床疗效可能不同。新一代ADC药物从机制上可以克服曲妥珠单抗耐药问题,未来联合治疗值得进一步探索。








.jpg)


