2023年6月第13届北京消化肿瘤国际高峰论坛暨中国胃肠肿瘤临床研究协作组(CGOG)年会于北京盛大召开。6月7日胃癌ASCO速递分会场上,中山大学肿瘤防治中心骆卉妍教授精选今年美国临床肿瘤学会(ASCO)上报道的胃癌靶向及转化研究进行精彩演讲。

CLDN18.2在正常胃粘膜细胞中表达,并保留在大多数G/GEJ腺癌中。今年ASCO胃癌靶向治疗方面,CLDN18.2靶点相关研究让人眼前一亮。
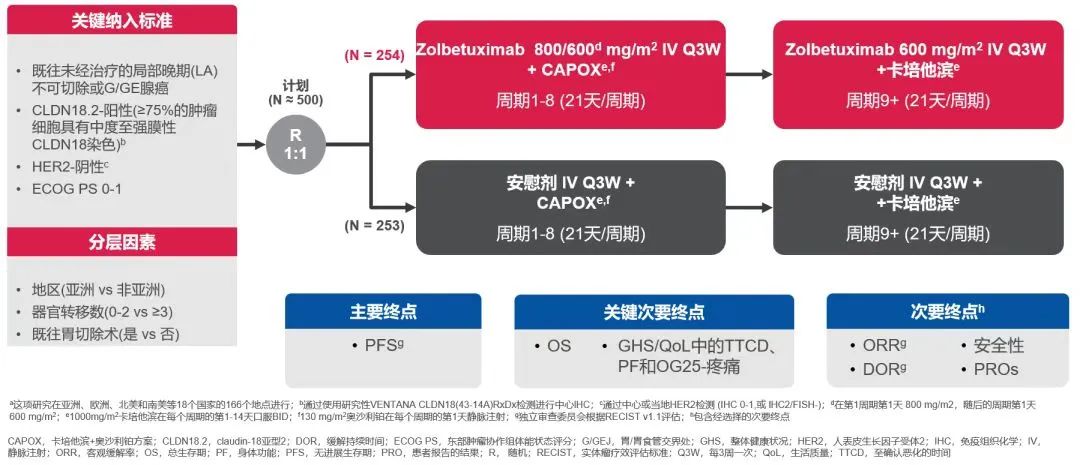
第一个重磅更新来自我国中山大学肿瘤防治中心徐瑞华教授团队。GLOW研究是一项III期的随机、多中心、双盲的临床研究。
主要研究终点是PFS,从安慰组的6.8个月,提高到试验组的8.21个月。
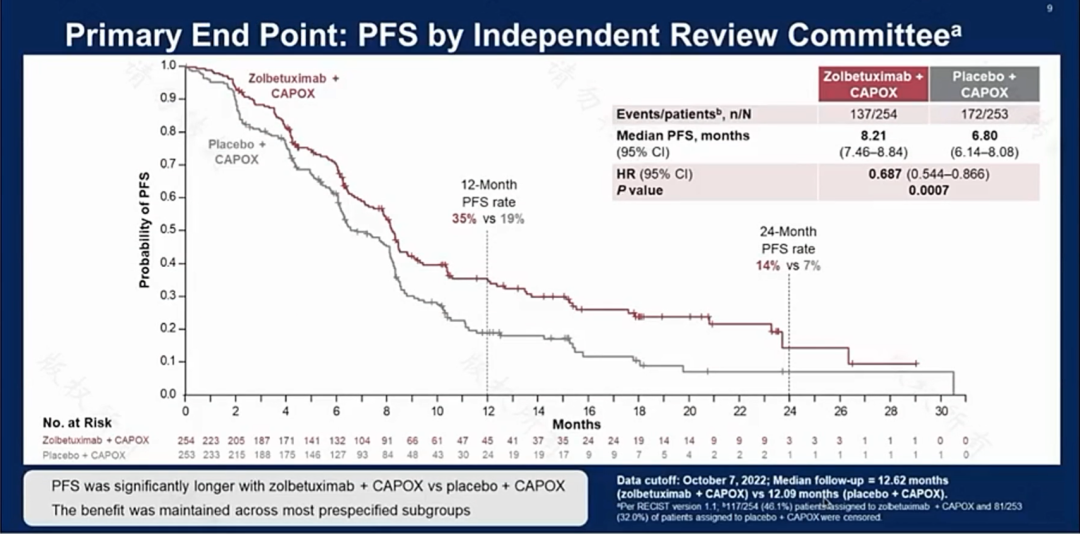
结论:使用Zolbetuximab联合CAPOX靶向治疗显著延长CLDN18.2+/HER2−LA不可切除或mG/GEJ腺癌的患者的PFS和OS,并且总体安全性可控,可以作为CLDN18.2+且HER2-患者的标准一线治疗。
1.OS从安慰剂组的12.16个月提高到试验组的14.39个月。
2.ORR、BOR、DOR两组差异不大,这意味着尽管PFS、OS均有一定延长,但治疗有效率没有明显提高。
3.观察试验安全性(TRAEs)最常见的是消化道反应(如恶心、呕吐),两组差异不是特别大。
消化道反应显著的原因,可能是CLDN 18.2主要位于胃黏膜上,也或许这解释了一个临床观察现象:已行胃切除手术的患者,恶心呕吐发生率较未做手术的患者下降。
SPOTLIGHT及GLOW两个研究共纳入4507例患者进行了CLDN18.2检测,其中CLDN18.2阳性定义为>75%的肿瘤细胞对CLDN18.2呈中高强度染色,这样的患者占研究人群的比例在38.4%。不同地区的CLDN18.2表达并不 一致,中国大陆CLDN18.2阳性表达率35%,
骆卉妍教授分析并总结SPOTLIGHT及GLOW两项研究得出的CLDN18.2与患者,肿瘤及样本特征的关系:
由此,骆卉妍教授认为对患者的原发灶、转移灶同时进行CLDN18.2检测的一致性可能会更好。
下面是今年ASCO公布的针对CLDN18.2的新型药物研究进展。骆卉妍教授先点评三项已有研究数据对外发表的研究摘要。
ZL-1211是一款人源化lgG1 mAb,能够特异性地与CLDN18.2高亲和力结合。通过Fc段的S239D和I332E的点突变提高ADCC作用。前期动物模型中展现了其体内抗肿瘤活性。
大会上公布了一组关于ZL-1211爬坡的数据,经过5个阶段的爬坡,截至2022年12月,剂量爬坡阶段共入组19例患者,患者中位年龄60岁,包括11例胰腺癌,6例胃癌,胆管癌和食管癌1例,78.9%患者接受过2线及以上的系统治疗。
骆教授讲解,这个研究的总体安全性不错,当研究爬坡到第4个阶段时,没有观察到剂量限制性毒性(DLT),常见不良反应仍然以胃肠道反应为主,如恶心、呕吐、腹痛等。
由于是单药研究,疗效未关注疾病有效率,观察疾病稳定率达到了60%,胃癌病例中有2例达到了稳定状态,3例出现肿瘤退缩,但是没有达到PR。
SYSA1801是一种抗CLDN18.2全人源单克隆抗体-MMAE药物偶联物。此前在CLDN18.2表达的多种细胞系和PDX模型中均显示出显著的抗肿瘤活性。
这项First-in-human开放标签,多中心I期临床研究,评估SYSA1801在CLDN18.2阳性的R/R实体瘤患者中的安全性,耐受性PK和有效性。
(1)五个剂量组(0.5-3 mg/kg,IV,Q3W)开展3+3剂量爬坡试验;
今年主要报道了该研究第一个阶段33例患者的研究数据,包括26例胃癌和7例胰腺癌患者,1/3患者接受过3线及以上的系统治疗。
SYSA1801的任意级别TRAEs发生率75.8%(25/33),≥3级TRAEs发生率24.2%(8/33),大多发生在最高剂量组(3.0mg/kg),无治疗相关死亡报道。主要TRAEs包括恶心,呕吐,干眼综合征和贫血。
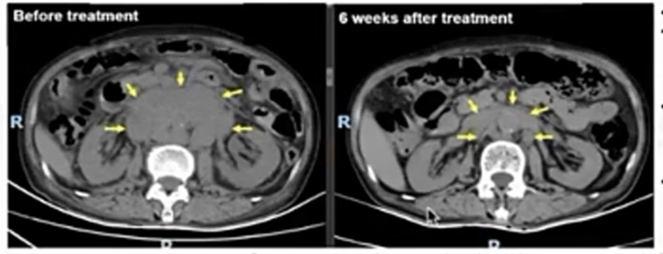
33例患者中21例患者可评估疗效,整体ORR 38.1%(8 PR),DCR 57.1%(8 PR,4 SD);17例可评估疗效的GC患者,ORR 47.1%(8 PR),DCR 64.7%(8 PR,3SD)。骆卉妍教授指出,从这项研究的结果来看,用SYSA1801治疗胃癌患者的有效率更高。下图为一位巨大腹膜后淋巴结患者SYSA1801治疗前(左)与治疗6周后(右)的对比图,肿物体积明显缩小。
这是一项由中国研究者牵头进行的多队列、多中心的使用TST001联合CAPOX一线治疗晚期G/GEJ患者的Ⅰ/Ⅱ期临床研究,旨在评估TST001联合CAPOX一线治疗G/GEJ肿瘤的有效性及安全性。截至2023年4月21日,共64例患者接受TSTO01联合CAPOX治疗,其中15例在剂量爬坡阶段入组,49例在6mg/kg的剂量扩展阶段入组。
入组患者具有典型一线G/GEJ患者特征,但腹膜转移率更高,意味着这些患者通常情况下预后也更差一些。
TST001(CLDN18.2)+CAPOX的安全性较好,TEAEs大部分为1-2级,最常见的TEARs包括恶心,低白蛋白血症,贫血和呕吐,没有4级药物不良反应发生。
载至2023年4月21日,42例患者在6mg/kg剂量扩展组有可测量病及肿瘤评估结果,28例(66.7%)获得PR。所有剂量组预计中位DOR为9.9个月,所有剂量组预计中位PFS为9.5个月。骆卉妍教授点评相较于之前SPOTLIGHT、GLOW研究,此新型单抗药物的疗效显现出一定优势,并期待这项由中国研究者研发的药物在有效率方面未来可以得到令人惊喜的突破。
骆卉妍教授简单讲解了另外两项新公布的、正在进行的针对CLDN18.2的研究。学习之前讲过的研究不难发现,目前主要治疗方案为ADC单药或与化疗药物联合,未来研究方向可能考虑进一步联合免疫治疗。这些研究是否会取得理想的治疗突破?骆卉妍教授表示拭目以待。
HER-2是除CLDN18.2之外最受人关注的靶点研究,尽管今年关于HER-2没有太多成熟的数据,仍然以Ⅰ/Ⅱ期临床研究为主,这些研究提示了新的靶点药物研发方向。以下是骆卉妍教授对不同药物研究进展的总结与分析。
T细胞抗原偶联剂(TAC)技术是一种修饰T细胞的新方法,使它们能够识别和治疗HER2+实体瘤。TAC01-HER2与CAR-T、TCR有相像之处,但不完全一致。它通过CD3的结合域紧密结合以后激活TCR,同时细胞因子释放的毒性小很多。该药物后续已设计了单药扩展试验以及联合药物试验。
此次主要报道了该药物Ⅰ期的爬坡试验结果。从安全性角度,最常见的不良反应是贫血,其次为细胞因子释放综合征。10位患者共经历了12例细胞因子释放综合征,其中11例为1-2级不良反应,1例为3级不良反应,没有观察到免疫相关的神经毒性。经过积极处理,大部分不良反应都能得到很好的控制。
从疗效来看,胃/胃食管结合部/食管癌症患者中,DCR达到83%,ORR达到33%。
该研究举了2个典型病例,两位胃癌患者均经历多线研究后进入该试验,例1达PR,例2达到CR。
BB-1701是一款以艾立布林为毒素的HER-2靶向ADC。当BB-1701靶向表达HER2的癌细胞并被内化时,游离的艾立布林被组织蛋白酶b从ADC上切割下来,并对癌细胞产生细胞毒性。邻近细胞受到旁观者效应的影响,体现为游离艾立布林对肿瘤细胞的细胞毒性和对微环境的非细胞毒性作用。
此次报道first-in-human I期治疗局部晚期/转移性HER-2表达实体瘤患者剂量爬坡的初期结果。研究采用传统3+3试验设计,共有8个剂量组(0.4mg/kg-4.0mg/kg).研究共入组29例患者,其中5例为G/GEJ肿瘤患者,目前已爬坡到第6个剂量组(2.6mg/kg),未观察到剂量限制性毒性(DLT)。
药物安全性方面,最常见的≥3级TRAEs为周围神经病变(15/29,51.7%),9例患者因周围神经病变中止治疗。
26例入组的多瘤种患者可以用于评估早期抗肿瘤活性,其中13例患者PR(ORR 50%),11例患者SD(DCR 92.3%),而5例入组的胃癌患者,均获得SD(疾病稳定)。
骆卉妍教授认为这样积极的数据有待进一步于更多局部晚期/转移性HER-2表达实体瘤研究中进行验证。
BDC-1001是一款first-in-class的免疫刺激抗体偶联物(ISAC),其涉及的抗体为妥珠单抗类似物(靶向HER-2)偶联TLR7/8激动剂,使用不可切割(non-cleavable)的连接子。BDC-1001可通过区域性激活固有免疫系统,产生持续性的肿瘤靶向免疫反应(Proposed MOA)。
此次大会上公布了BDC-1001(HER-2 ISAC)治疗HER-2表达的晚期实体瘤患者1/2期研究。爬坡阶段设置了单药组,以及与纳武利尤单抗联合对照组。BDC-1001单药组共入组94例患者,其他24例为胃食管(Gastroesophageal)肿瘤患者;BDC-1001联合纳武利尤单抗组共入组37例患者,其中4例为胃食管肿瘤患者。
总体而言,药物耐受性良好,达到20mg/kg q1w时未达到最大耐受剂量。在在RP2D 20mg/kg q2w剂量组中,7例接受BDC-1001单药治疗,2例(29%)获得PR;7例接受BDC-1001联合纳武利尤单抗单抗治疗,2例(29%) 获得PR。II期推荐剂量为20mg/kg q2w时,7例接受BDC-1001单药治疗,2例(29%)获得PR;7例接受BDC-1001联合纳武利尤单抗单抗治疗,2例(29%) 获得PR。由此可见该药物安全性与有效性均佳。
骆卉妍教授介绍了下一个靶向HER2的抗体降解剂偶联物(AnDC)新药物——ORM-5029。该药物为帕妥珠单抗耦联强效GSPT1降解分子胶(SMol006)所形成。骆教授期待该药物在HER-2高表达胃癌患者中有突破进展。
有研究分析30-70%的转移性/不可切除G/GEJ患者有TP53突变,且与不良预后相关。这样的研究背景下,一项单臂2期临床研究,评估伊立替康联合ATR抑制剂Berzosertib(M6620) 三线治疗TP3突变的G/GEJ腺癌患者。然而,骆卉妍教授遗憾表示该研究结果为16例患者中只有1例达到PR,这意味着并没有达到主要治疗终点。唯一令人振奋的消息是,与伊立替康单药治疗历史数据相比,PFS有所延长。
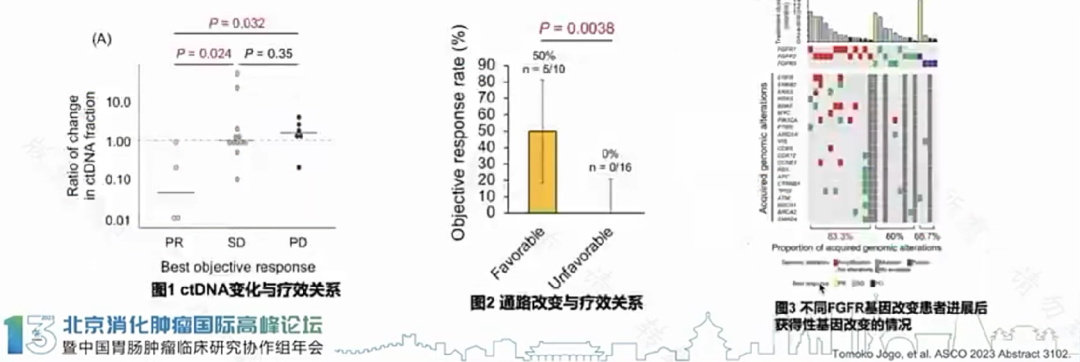
一项研究者发起的多中心、2期篮式TIFFANY研究,评估Futibatinib(一款泛FGFR抑制剂)治疗难治性或不耐受SOC治疗的FGFR改变(由ctDNA识别)晚期实体肿瘤患者,主要研究终点为研究者评估的ORR。
研究入组26例FGFR改变的患者(9例突变,13例扩增,4例融合)。
研究达到主要终点,5例(19.2%)患者获得确认的PR(包括胆管癌,胃癌1例,尿路上皮癌,尿管癌)。中位PFS为2.6个月,中位OS为8.9个月。
-
获得PR的患者与SD或PD(疾病进展)患者相比,基线与治疗3周后ctDNA比值变化的中位值显著更低(0.11 vs.10 vs.1.6)(图1);
-
无合并RTK/RAS/PI3K和细胞周期通路改变的惠者,与至少有其中一种通路改变的惠者相比,Futibatinib 治疗反应率明显更高(ORR 50%Vs0%:P=0.0038)(图2);
-
FGFR扩增的患者,与FGFR突变或融合康者相比,疾病进展后ctDNA检测到获得性基因改变更常见(83.3% VS 60% VS 66.7%)(图3)。
香港中文大学的研究人员收集了19万人群数据建立模型进行胃癌筛查。众所周知,胃镜作为胃癌筛查金标准,但患者面对胃镜检查的依从性不佳,因此有必要探索更简便的筛查方法。
这项研究主要收集了肝肾功能、电解质、凝血功能等常规指标来进行AI分析。数据不仅收集了胃癌患者,还收集了无胃癌但既往于2004-2015间用过消化不良药物的患者。随机挑选80%的样本用于数据训练,20%的样本用于检测模型。从结果来看,模型区分癌症患者与正常患者的准确度可达99%以上。此外,该模型的临床可信度、可解释性、普适性同样出色。
骆卉妍教授认为这项模型有望应用于临床,可以作为筛查有潜在胃癌风险患者的辅助工具。
目前PD-1联合化疗已成为转移性胃食管肿瘤(mEGC)一线治疗的标准方案,虽然反应率高,但并非所有惠者均能获益,提示需要更好的生物标志物。
KeyLargo研究采用基于肿瘤信息的ctDNA对疾病进行纵向监测。该研究收集18例患者基线及治疗中的共116份血浆样本进行回顾性分析。
-
2例CR患者,治疗后超过2年时间的21份血浆样本均为ctDNA阴性。
-
所有SD和PD患者在所有评估时间点均检为ctDNA阳性。
-
所有患者在临床进展时或进展前都能检测到ctDNA。
-
每3个周期(9周)采集治疗中(on-treatment,OT)样本,30天后任意时间的ctDNA清除与PFS相关(p=0.018)。
-
基线与首个OT样本的ctDNA比值(rPPM),PR/CR患者下降的比例明显比PD患者更多(98% vs 45%,p<0.007)。
骆卉妍教授指出监测ctDNA可以预测免疫治疗癌症患者的疗效与预后。
一项II期研究评估avelumab与雷莫西尤单抗及紫杉醇(RAP)二线治疗转移性食管胃腺癌(EGA)的有效性及安全性。研究者评估ORR30.5%,DCR 79.7%,DOR 8.2个月,中位PFS 5.4个月,中位OS 10.6个月,6个月OS率71.2%。
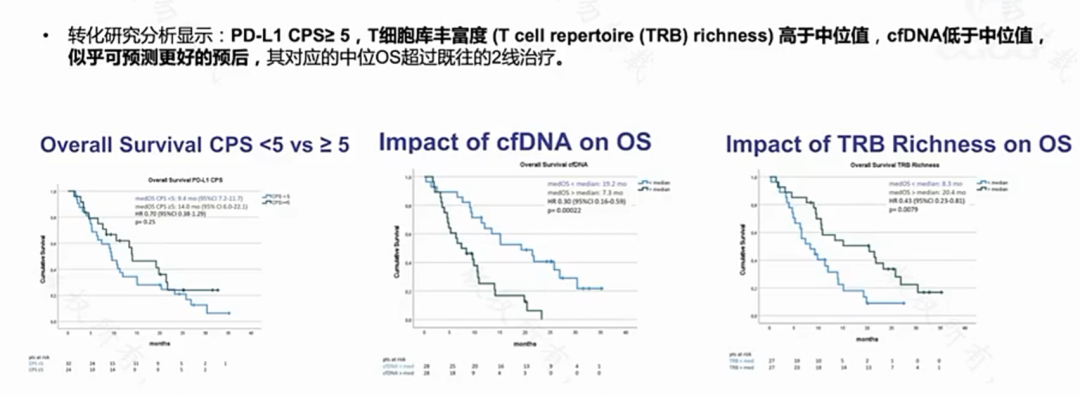
转化研究分析显示:PD·L1 CPS≥5,T细胞库丰富度[T cell repertoire(TRB) richness)]高于中位值,cfDNA低于中位值似乎可预测更好的预后,其对应的中位OS超过既往的2线治疗。
-
随着SPOTLIGHT,GLOW研究阳性结果的公布,晚期胃癌的靶向治疗有了新的突破;
-
随着分子信号通路的逐渐阐明,针对既有靶点新的药物分子设计或全新作用机制的靶点,晚期胃癌靶向治疗的研究正如火如荼开展;
-
靶向与免疫的联合治疗,会给未来晚期胃癌带来哪些新的变化,值得进一步探索;
-
积极推动转化研究的开展,对早期胃癌的筛查,指导晚期胃癌的精准化治疗等有重要意义。








.jpg)


