可提示低核分化等级DCIS的影像学和病理学相关征象
乳腺导管原位癌(DCIS)约占新诊断的乳腺癌的25%,由于乳腺癌筛查的普及,其检出率正在上升。目前DCIS的标准治疗方法包括手术后的辅助治疗,如放疗及内分泌治疗。由于DCIS是浸润性乳腺癌的前身,没有发展成浸润性疾病的DCIS病变不会引起症状或死亡,因此人们逐渐开始关注DCIS的过度治疗。
乳腺导管原位癌(DCIS)约占新诊断的乳腺癌的25%,由于乳腺癌筛查的普及,其检出率正在上升。目前DCIS的标准治疗方法包括手术后的辅助治疗,如放疗及内分泌治疗。由于DCIS是浸润性乳腺癌的前身,没有发展成浸润性疾病的DCIS病变不会引起症状或死亡,因此人们逐渐开始关注DCIS的过度治疗。
然而,区分高危DCIS和低危DCIS的预测因素尚未明确,尽管一些临床病理因素(如年轻、病灶较大、激素受体阴性、人表皮生长因子受体2[HER2]阳性、高核分化等级、绒毛膜病变和阳性边缘状态)与DCIS患者的死亡率或复发有关。然而这些因素的相对重要性和相互关系仍不明确,以目前的知识,很难准确预测哪些DCIS患者发展为浸润性乳腺癌的风险更大。
高核分化等级DCIS与高核分化等级浸润性乳腺癌的发生有关,与低核分化等级DCIS相比,高核分化等级浸润性乳腺癌在生物学上更具有侵略性。因此,术前对低核级DCIS进行识别对这些患者来说至关重要。不过,目前还不清楚术前用芯针活检或真空辅助活检(VAB)评估的DCIS的核分化等级是否可以代表整个病变的核分化等级。
近日,发表在Radiology杂志的一项研究评估了与低核分化等级DCIS相关的临床、组织病理学和影像学因素,并开发和验证了一个术前识别低核分化等级DCIS的模型,并进一步明确了与活检时低核分化等级DCIS相关的具体因素。
本项回顾性研究纳入了470名女性患者(中位年龄,50岁;四分位数范围,44-58岁),手术组织病理学评估时有477个为DCIS病变(2010年1月至2015年12月)。患者被分为训练集(n = 330)或验证集(n = 147)以建立一个术前模型来识别低核分化等级DCIS。并对US(肿块、非肿块)和乳腺钼靶(形态学特征、微钙化的分布)的特征进行了评估。计算了低核分化等级DCIS的升级率,并使用多变量回归来评估与后来没有升级的低核分化等级DCIS的相关因素。
将在US表现为肿块但没有微钙化、活检时没有绒毛的病变用来建立一个识别低核分化等级DCIS的术前模型,在验证组中,受试者工作特性曲线下的面积高达0.97(95% CI: 0.94, 1.00)。活检时低核分化等级DCIS的升级率为38.8%(129例中的50例)。Ki-67阳性(几率比,0.04;95% CI:0.0003,0.43;P = .005)与持续的低核分化等级DCIS呈反比。
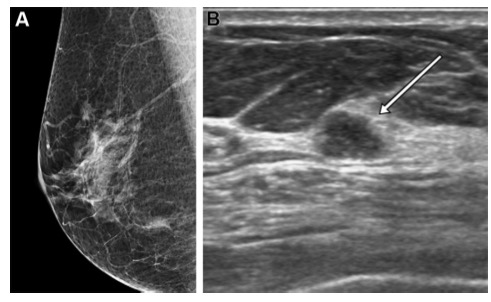
图62岁女性,诊断为低核分化等级DCIS。(A) 乳腺钼靶显示没有相关的微钙化或其他发现。(B) US图像显示7毫米等回声微球状结节,位于右乳12点位置,距乳头3厘米(箭头)
本研究表明,活检时的低核分化等级原位癌(DCIS)升级为手术时的中高核分化等级的比率为38.8%。然而,DCIS在US表现为肿块、没有微钙化、在活检组织病理学评估时没有绒毛这几点征象,可以用来识别最终组织病理学评估时的低核分化等级DCIS。
原文出处:
Si Eun Lee,Ga Ram Kim,Kyunghwa Han.US, Mammography, and Histopathologic Evaluation to Identify Low Nuclear Grade Ductal Carcinoma in Situ.DOI:10.1148/radiol.211425


.jpg)



