肿瘤细胞表达免疫调节因子重塑肿瘤微环境(TME)并促进肿瘤免疫逃逸,这是癌症进展的标志。因此,TME靶向治疗打破肿瘤诱导的免疫耐受是研究的热点。其中,一项重大进步是开发出了免疫检查点抑制剂。
肺癌是所有癌症中死亡率最高的,治疗选择极其有限,特别是对于 KRAS 基因致癌突变的患者。一些患者对免疫检查点抑制剂治疗反应良好,而大多数癌症患者则完全无效。因此,需要更好地理解改变肿瘤微环境(TME)的因素,以避免对无反应者施用昂贵且具有副作用的免疫检查点抑制剂来疗法。
驱动肿瘤进化的基因突变会调节TME,而这会直接影响免疫治疗效果。A20,也被称为肿瘤坏死因子α诱导蛋白3(TNFAIP3),是一种有效的抗炎酶和炎症稳态的关键因子。A20具有广泛的靶向作用,能够促进k48连接的泛素化、激活NF-kB、抑制凋亡和自噬。A20/TNFAIP3基因的各种多态性导致功能基因产物的表达减少与炎症和自身免疫性疾病有关,但在癌症中A20的作用仍然存在争议。
近日,维也纳医科大学的研究团队在 Science 子刊 Science Translational Medicine 发表了题为:Down-regulation of A20 promotes immune escape of lung adenocarcinomas 的研究论文。
该研究发现,肿瘤细胞内在的A20缺失显着增强了肺癌发生,并与CD8+ T细胞介导的免疫监测下降相关。在机制上该研究阐明了A20是调节TBK1-STAT1-PD-L1轴的主要免疫检查点,有望用于改善肺腺癌患者的免疫检查点治疗。

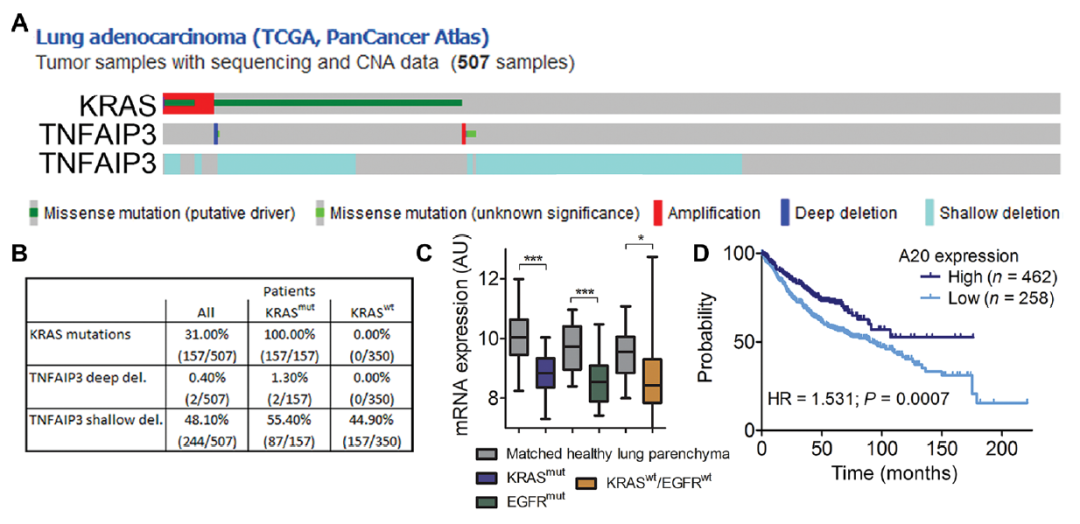
K-Ras 是一种单体 G 蛋白,存在于NF-kB信号通路,在恶性肿瘤的生长中起关键作用。KRAS 突变的肺癌经常发生在慢性发炎的肺部,尤其是重度吸烟者。研究团队分析了肺腺癌患者的TCGA数据。他们发现,有两名患者存在K-RAS驱动突变,并伴有编码A20蛋白的TNFAIP3基因的缺失。肿瘤组织中A20下调,并且患者的预期寿命与该蛋白的表达之间存在直接相关性。在KRAS突变的肿瘤小鼠模型中,研究团队发现A20抑制由K-Ras驱动的肺腺癌进展。
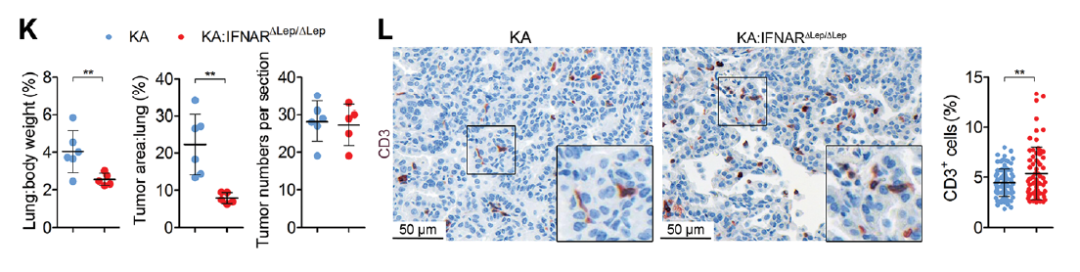
接下来,研究团队旨在了解A20下调促进肿瘤免疫逃逸的分子机制。他们进行了RNA测序和GSEA标记基因集来分析A20敲除小鼠的肺腺癌基因表达情况。结果表明,IFN信号的改变对于A20的肿瘤抑制功能至关重要。
来自不同癌症患者的数据表明,肿瘤细胞内在的IFN信号在ICB治疗应答中发挥重要作用。因此,研究团队创建了一个A20功能丧失模型。有趣的是,从总生存期和无进展生存期可以看出,A20 LOF标记较高的黑色素瘤患者对PD-1阻滞的反应更好。ICB治疗模型小鼠的结果也证明了肿瘤中低A20表达导致IFN表达基因特征的增加,使这些肿瘤更容易受益于ICB治疗。

总的来说,该研究揭示了A20在肺腺癌中的肿瘤抑制功能,阐明了A20是调节TBK1-STAT1-PD-L1轴的主要免疫检查点,A20有望用于优化肺腺癌患者的免疫检查点治疗之中。
原始出处:
Kristina Breitenecker, et al. Down-regulation of A20 promotes immune escape of lung adenocarcinomas. Science Translational Medicine 07 Jul 2021:Vol. 13, Issue 601, eabc3911. DOI: 10.1126/scitranslmed.abc3911.






