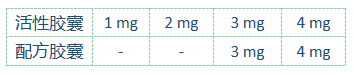新药治疗复发性或难治性非霍奇金淋巴瘤
Avadomide(CC-122)是一种新型的口服脑神经调节剂,在非霍奇金淋巴瘤中具有广阔的前景。本研究旨在评估avadomide联合奥比妥单抗在复发性或难治性非霍奇金淋巴瘤的安全性和初步活性。
Avadomide(CC-122)是一种新型的口服脑神经调节剂,在非霍奇金淋巴瘤中具有广阔的前景。本研究旨在评估avadomide联合obinutuzumab(奥比妥单抗)在复发性或难治性非霍奇金淋巴瘤患者中的安全性和初步活性。
这是一个在法国、意大利和荷兰的8个中心开展的1b期剂量递增和扩展研究,招募年满18岁的确诊的CD20+的复发性/难治性非霍奇金淋巴瘤患者。在剂量扩展阶段,只纳入既往治疗过的复发性/难治性滤泡性淋巴瘤(1、2或3a级)。Avadomide以两种配方递增剂量给药,连用5天,停2天,28天/疗程。Obinutuzumab 1000 mg静滴,第1个疗程的第2、8和第15天和第2-8疗程的第1天给药。主要目的是明确Avadomide的安全性和耐受性、最大耐受剂量和推荐的2期剂量(RP2D)。
(Avadomide的给药方式及剂量)
2015年6月24日-2018年12月5日,共招募了73位患者:19位弥漫性大B细胞淋巴瘤、53位滤泡性淋巴瘤和1位边缘区淋巴瘤。中位随访253天。既往抗肿瘤治疗的中位次数是3次。最大耐受剂量未达到。基于安全性和药代动力学数据,avadomide与Obinutuzumab联合使用时配方胶囊的RP2D为3.0 mg。扩展队列的患者接受该RP2D剂量治疗。3位患者出现剂量限制性毒性,其中一位是采用RP2D剂量治疗(3级败血症)。最常见的≥3级不良反应有中性粒细胞减少(56%)和血小板减少(23%)。34位(47%)患者发生严重不良反应事件,其中23位(32%)考虑是与avadomide相关,20位(27%)考虑与Obinutuzumab相关。2例治疗相关死亡,一例死于肿瘤发作,一例死于研究终止后的急性髓系白血病。
总结:Avadomide联合Obinutuzumab的毒性作用可控,对于大部分患者可耐受。虽然疗效阈值未达到预期,但研究人员认为脑神经调节剂联合二代抗CD20单抗用于复发性/难治性非霍奇金淋巴瘤的抗肿瘤活性值得进一步研究。